Thèse présenté à Université Paris VI
pour obtenir le grade de Docteur es
Sciences
par
Jean Andrieux
Synthèse et réactivité de perchlorates
de flavylium
soutenue le 18 December 1972
devant la commission d'examen :
Maitte, président
Cadiot et Molho, examinateurs
INTRODUCTION
Rappelons
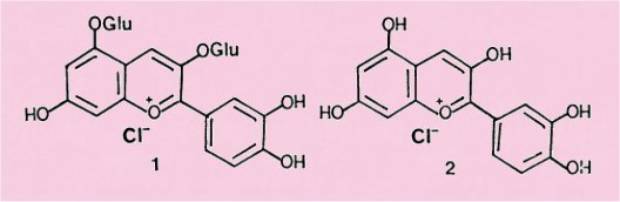
tout d'abord que les sels de flavylium polyhydroxylés sont très répandus dans
le règne végétal : ce sont les anthocyanines, 1, responsables de la
couleur rouge ou bleue des fleurs et des fruits.
Les
anthocyanines sont des glucosides et, par hydrolyse en milieu acide, ils
libèrent les aglycones correspondants, connus sous le nom d'anthocyanidines,
2.
Les
relations existant entre ces anthocyanines et les divers composés
flavoniques, tels que les flavones, flavonols, fiavanne diols, catéchines,
ont été clairement mises en évidence : la même plante contient souvent, à
côté des anthocyanines, des dérivés flavoniques ayant le même type de
substitution sur les noyaux.
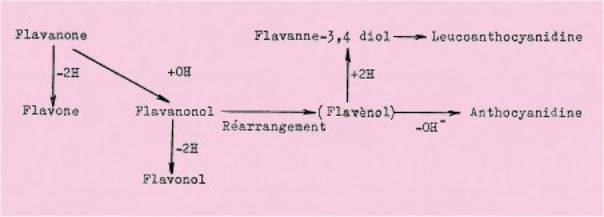
Tous ces
dérivés, de structure C6-C3-G6 ne diffèrent que par un changement du degré
d'oxydation au niveau de l'enchaînement C3. et le schéma biogénétique,
généralement admis pour le passage d'une classe de composés à l'autre, est le
suivant
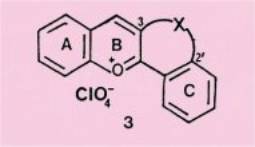
Nous nous
sommes, pour notre part, intéressés plus spécialement aux sels de flavylium
du type 3 , dont les positions 3 et 2' sont reliées par divers enchaînements.
En effet,
un assez grand nombre de produits naturels comportent un squelette de ce
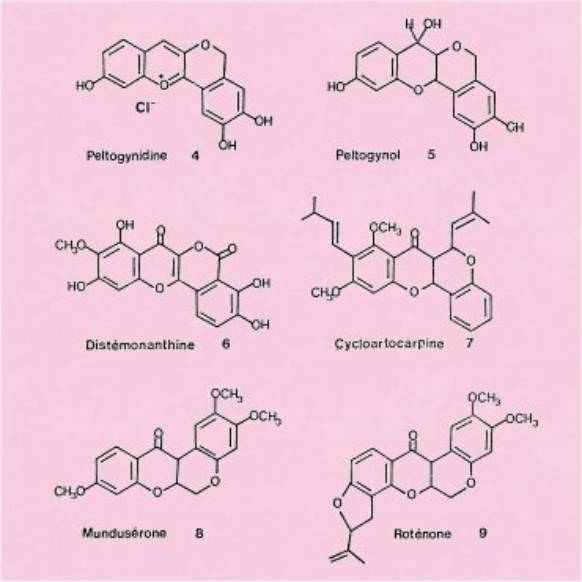
type. C'est le cas, par exemple, du chlorure de peltogynidine qui est un sel
de flavylium naturel répondant à la formule générale 3.
De plus, on
trouve des composés ayant des degrés d'oxydation différents, tels que le
peltogynol 5, la distémonanthine 6 ou la cycloartocarpine 7.
On peut,
d'ailleurs leur rapprocher les roténoïdes, mundusérone 8 et roténone 9, qui
sont des isoflavonoïdes comportant également un enchaînement entre les cycles
A et C.
Nous nous
sommes donc proposés dans ce travail de préparer un certain nombre de sels de
flavylium et ensuite d'en étudier la réactivité.
Or, si les
sels de flavylium ont fait l'objet de nombreux travaux en ce qui concerne
leur synthèse, leur réactivité a été moins étudiée ; en particulier, les méthodes d'oxydation citées conduisent
le plus souvent à la dégradation de la molécule.
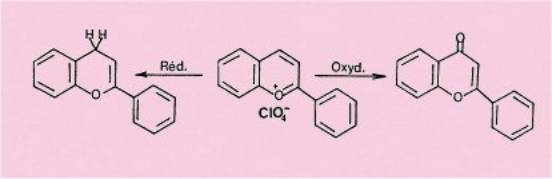
Les sels de
flavylium étant à un degré d'oxydation intermédiaire entre les flavones et
les flavènes, on pouvait espérer aboutir à ces dérivés par oxydation ou
réduction.
Parmi les
méthodes de synthèse des sels de flavylium décrites nous avons retenu celle
de Robinson et coll., que nous avons améliorée par l'emploi d'un agent de
condensation énergique ; une solution acétique d'acide perchlorique anhydre.
Cette modification a permis d'étendre cette méthode à la synthèse de
perchlorates de flavylium arylés ou alkylés en position 4 pour laquelle elle
n'avait pas été développée.
Nous avons
abordé ensuite la réactivité de ces sels.
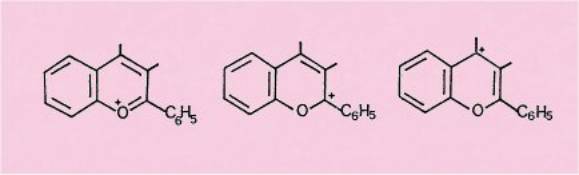
Le cation
flavylium, comportant une lacune électronique différemment localisée dans les
trois contributions principales de l'hybride de résonance, est donc
susceptible de réagir avec les agents nucléophiles en position 2 ou en
position 4.
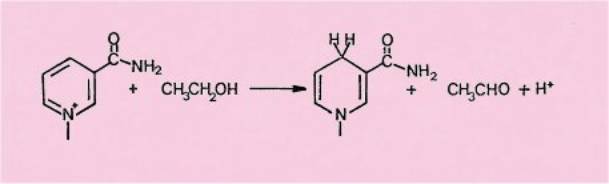
L'étude de la réduction a montré que celle-ci se faisait par
transfert d'un ion hydrure, indiquant que ces sels de flavylium 3 se
comportaient d'une façon tout -à fait analogue au nicotinamide adénine
nucléotide (D P N ) (coenzyme de l'alcool déshydrogénase), qui oxyde l'alcool
éthylique de l'organisme en acétaldéhyde et constitue, à ce titre, un maillon
essentiel de la chaîne respiratoire.
II serait d'ailleurs intéressant de voir si
les anthocyanines peuvent, dans la nature, jouer un rôle identique.
Nous avons,
ensuite, mis au point une méthode d'oxydation des perchlorates de flavylium
du type 3 en flavones correspondantes.
L'étude de
la réactivité des sels de flavylium vis-à-vis de l'acétone et de
l'acétophénone a été entreprise. Elle a permis, en particulier, de mettre au
point une nouvelle méthode de synthèse de perchlorates de méthyl-4 flavylium
et de méthyl-9 xanthylium.
Enfin,
l'obtention d'éthers méthyliques par action du méthanol permet de
différencier les sels de flavylium selon leur aptitude à réagir en position 2
ou 4.
L'étude
comparée de leurs réactivités met en lumière l'influence de l'agent
nucléophile sur la position la plus réactive du cation flavylium.
Le plan de
notre exposé sera le suivant :
- Première
partie : Synthèse de perchlorates de fiavylium.
Chapitre
1 : Synthèse et propriétés physiques de perchlorates de flavylium non
substitués en position 4
Chapitre
II: Synthèse et propriétés physiques de perchlorates de flavylium arylés ou
alkylés en position 4
- Deuxième
partie : Réactivité des perchlorates de flavylium non substitués en
position 4
Chapitre
III : Réduction et oxydation des perchlorates de flavylium non substitués en
position 4
Chapitre
IV : Réactivité des perchlorates de
flavylium non substitués en position 4 vis-à-vis des méthylcétones et des
alcools. –
- Conclusions.
Mots clefs :thèse / andrieux / perchlorate / oxydation / méthode / anthocyanine / synthèse / réactivité / flavone / étude /
flavylium / réduction / réactivité / propriété / physique / nucléophile / flavonique /
arylé / alkylé / alcool / sels / xanthylium / structure / squelette / roténone / roténoïde /
réduction / réactivité / polyhydroxylé / plante / perchlorique / peltogynol / peltogynidine
/ oxyde / nucléotide / noyaux / nicotinamide / mundusérone / molécule / perchlorate
|
|
visiteurs |
|---|