Thèse de
chimie organique présentée à la Faculté des sciences de l'Université de Paris
pour
obtenir le grade de Ingénieur-Docteur
par
Jean Lecocq
Contribution
à l'étude de la bromurtion par la n-bromosuccinimide
soutenue
le 13 juin 1947
devant la
commission d'examen :
Pascal,
président
Aubel,
Prévost, C., examinateurs
INTRODUCTION
Le sujet de notre thèse
est l'étude de la bromuration des chaînes latérales par la N-bromosuccinimide
en série aromatique.
La bromuration par la
N-bromosuccinimide a été mise au point par Zieg-ler en 1941 (Liebig-s, A/m.
der Chemie, 551 (iQ^i), 80), à propos de la synthèse de la cantharidine. Elle
permet la bromuration des composés non saturés aliphatiques en position
allylique :
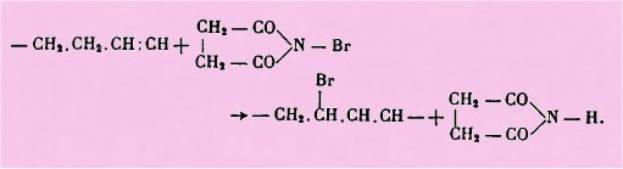
L'intérêt d'une telle
méthode est considérable. Le brome fixé ainsi en a d'une double liaison est
en effet mobile. Par ailleurs, le produit brome formé perd de l'acide
bromhydrique sous l'influence d'un ag-ent alcalin, comme la quinoléine, en
donnant naissance à une double liaison conjuguée :
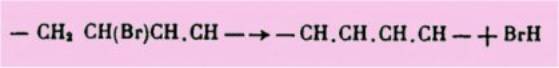
Enfin, la technique de
bromuration par la N-bromosuccinimide est extrêmement simple. On opère dans
le tétrachlorure de carbone : la succinimide formée après bromuration y est
insoluble. Il suffit de filtrer pour avoir le produit brome seul en solution
dans le tétra-chlorure.
Aussi, depuis le travail
de Ziegler, la bromosuccinimide a-t-elle suscité un très vif intérêt. Elle
est devenue un produit commercial.
Buu-Hoï a montré qu'elle
peut également servir à bromer les composés aromatiques dans leurs chaînes
latérales et donner ainsi très facilement les dérivés bromométhylés. Ainsi le
b-méthylnaphtalène donne le b-bromométhylnaphtalène :
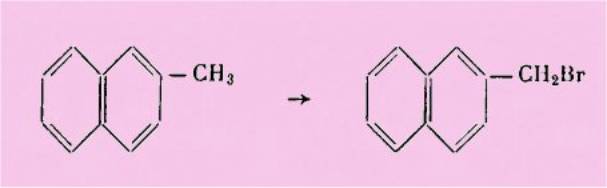
C'est cette réaction que
nous étudions dans notre thèse. Nous l'avons étendue à la série
hétérocyclique (coumarine, pyrone, thiophène, furan). Nous essayons de
montrer que la facilité de la bromuration :
Ar.CH3 → Ar.CH2.Br
augmente lorsque Ar
devient moins saturé (c'est-à-dire lorsque les doubles liaisons prennent un
caractère aromatique moins prononce). Par ailleurs, la mobilité de l'atome de
brome fixé augmente dans le même sens.