lor:green'>Thèse de Chimie et de Physique présentée à Faculté
des sciences
de l'Université de Paris
pour obtenir le grade de Docteur de l'Université de
Paris
par
René Lecuir
Etude chimique et magnétique
de quelques sels complexes organiques
soutenue en 1930
devant la commission d'examen :
Pascal, président
Guichard, Darmois, E., examinateurs
INTRODUCTION
Ableg et Bodlander
définissaient les combinaisons complexes : des sels dans lesquels l'un des
ions peut être considéré comme une combinaison moléculaire résultant de
l'union d'un ion simple avec une molécule électriquement neutre. Messieurs
Urbain et Sénéchal, dans leur livre Introduction à la chimie des complexes,
objectent que cette manière de voir ne peut être considérée comme conforme
aux faits s'il ne s'agit de sels doubles. Elle est discutable dans le cas de
certains complexes parfaits. Aussi, pour ces derniers auteurs : tantôt les
ions sont formés d'un seul atome, ce sont les ions simples ; tantôt ils sont
formés de plusieurs atomes, ce sont des ions complexes.
Ces ions complexes, au moins pour leur partie non
dissociée, qu'ils soient électronégatifs ou électropositifs, possèdent les
caractères de véritables corps simples. Jusqu'ici, leur étude a été plus
particulièrement faite en solution. Si ces combinaisons sont susceptibles de
résister à l'hydrolyse, leurs solutions ne donnent pas avec les réactifs
chimiques de leurs éléments constitutifs les colorations où les précipités
accoutumés. Le plus souvent l'ion complexe est dissocié, et par suite, on retrouve
les réactions analytiques atténuées ou partielles des divers éléments.
La présence d’un atome
métallique dans un ion complexe n'est pas caractéristique de ce genre de
combinaisons ; mais l'utilité que présente l'étude des réactions analytiques
des sels minéraux, et le nombre considérable des ions complexes susceptibles
de se grouper autour de certains atomes métalliques, a particulièrement
développé la chimie des complexes minéraux.
Nous avons été frappé du
petit nombre de sels organiques dont les propriétés sont bien connues.
Il était intéressant de
poursuivre l'étude de ces composés. Sur les conseils de M. Pascal, nous avons
préparé et cherché parmi eux des ions électronégatifs complexes.
M. Pascal, étudiant les
sels de fer complexes a remarqué que la disparition des propriétés chimiques
du métal entraîne parallèlement celle de ses propriétés magnétiques. Bien
plus, on peut suivre la dissociation de l'ion complexe par la variation de la
susceptibilité magnétique de la solution. Ainsi du point de vue magnétique,
l'existence d'un ion complexe se traduit par une dérogation à la loi énoncée
par Wiedemann : «Le magnétisme moléculaire de sels d'un même métal est
sensiblement constant»
Le coefficient
d'aimantation moléculaire varie peu pour les sels de même constitution d'un
même métal et se trouve fortement abaissé quand on a affaire à des sels
complexes. Cette conclusion étendue de l'état dissous aux molécules solides
par Mme Cotton-Feytis, lui permit l'examen des sels de cobaltammines, tout en
évitant les modifications qu'ils éprouvent fréquemment en solution. Ainsi,
l'emploi du champ magnétique comme réactif des combinaisons complexes
présente l'avantage de saisir ces composés sous leur forme stable initiale
indépendamment de toute hydrolyse ; de plus, il est possible d'aborder
l'étude de la constitution des corps insolubles dans tous les réactifs
usuels.
Si on a soin d'effectuer
les mesures à température constante, on peut avoir sur les sels complexes
mieux que des indications qualitatives.
Soit en effet RM, un sel
complexe d'un métal paramagnétique M. La mesure de sa susceptibilité
moléculaire permet, connaissant celle du radical acide R, de calculer la part
contributive Mi du métal dissimulé. Wiedemann a donné les susceptibilités
globales de sels des différents métaux, négligeant en première approximation
le rôle du radical acide. Soit I la susceptibilité du métal M. Nous
définirons au point de vue magnétique la complexité du composé RM par le
rapport :
I – Mi
I
Posons : D == I — M ;
Si D == 0, du point de
vue magnétique, le sel étudié n'est pas complexe.
Si D/I > 1, le composé complexe est
diamagnétique
Si D/I <1, le composé complexe est
paramagnétique.
On peut ainsi aborder le problème énoncé par Mme
Cotton-Feytis. «Etant donné un type de complexe, on peut se proposer de voir
comment le magnétisme moléculaire est modifié par l'intervention de
différents groupements, NH3, H2O, Cl-, OH-et affecter chacun d'eux d'un
module qui le caractérise dans les combinaisons du même genre»
Abbeg et Bödlander ont
signalé que la tendance à la formation des complexes décroît quand l'électro
affinité croît Les métaux moins électropositifs que l'hydrogène donnent seuls
des radicaux électronégatifs complexes. Les mêmes auteurs mentionnent que
dans la série: Cl, Br, I, CN, la tendance à la formation des sels complexes
va en croissant de Cl à CN.
Nous avons pensé que
l'étude des propriétés magnétiques des sels complexes nous permettrait
peut-être de mettre en valeur le rôle joué par certains groupements CO2, CN,
NH2, le noyau benzénique, les doubles liaisons et de contribuer ainsi à
l'étude de la constitution de certains composés organiques
Dès
avant 1900, Fleury avait isolé les premiers sels organiques complexes,
remarquant que les acides tartrique, malique, citrique empêchent la
précipitation des métaux lourds par la potasse en donnant des sels analogues
aux émétiques. L'étude des radicaux complexes donnés par l'antimoine, le
bismuth, le bore, le cuivre, le cobalt trivalent avec l'acide tartrique et
parfois l'acide malique a déjà fait l'objet d'un grand nombre de travaux.
Thomas a préparé le ferro et le ferri-oxalate de potassium. Weinland a
signalé la présence du fer dans les anions complexes qu'il forme avec les
acides glycolique, malonique, lactique.
Pour préparer de nouveaux
sels complexes dérivés d'acides cycliques et hétérocycliques, nous nous
sommes adressés aux acides triazine tricarboxylique, cyanurique, mellique.
L'étude chimique et magnétique de ces composés constitue la première partie
de ce travail.
Assuré alors du rôle
important joué par le groupement carboxyle dans la formation des ions
complexes-nous avons poursuivi l'étude des dérivés cobalteux d'acides gras à
chaîne de quatre atomes de carbone.
Dès avant 1900, Fleury
avait isolé les premiers sels organiques complexes, remarquant que les acides
tartrique, malique, citrique empêchent la précipitation des métaux lourds par
la potasse en donnant des sels analogues aux émétiques. L'étude des radicaux
complexes donnés par l'antimoine, le bismuth, le bore, le cuivre, le cobalt
trivalent avec l'acide tartrique et parfois l'acide malique a déjà fait
l'objet d'un grand nombre de travaux. Thomas a préparé le ferro et le
ferri-oxalate de potassium. Weinland a signalé la présence du fer dans les
anions complexes qu'il forme avec les acides glycolique, malonique, lactique.
CONCLUSION
Les nombreuses combinaisons
formées par double décomposition entre les acides organiques ou leurs sels
alcalins et les sels des métaux paramagnétiques engagent fréquemment le métal
lourd en un ion complexe La disparition des réactions chimiques du métal,
d'ailleurs plus ou moins nette marque toujours dans ces composés le passage
du métal dans l'anion. Parallèlement on observe une anomalie magnétique. Pour
un métal paramagnétique engagé dans un ion complexe, cette anomalie se
traduit par une diminution de son paramagnétisme. Il est alors possible de
donner du phénomène une expression quantitative et de comparer ainsi les
divers ions complexes : il faut effectuer la mesure de la susceptibilité
spécifique du composé après l'avoir réduit à l'état pulvérulent. Les mesures
sont ainsi comparables, les diversions étant saisis en leur état primitif
indépendamment de toute hydrolyse et de l'erreur possible due à la concentration.
Cette méthode est d'ailleurs seule applicable pour étudier la constitution
des corps insolubles dans les solvants connus, phénomène fréquent chez les
composés que nous avons étudiés.
La comparaison des
constitutions de ces anions complexes met en évidence la présence de certains
groupements fonctionnels qui sont nécessaires a leur formation. Ceux-ci ne
sont pas sans analogie avec les groupements dits chromophores. Parmi ces
groupements, nous avons signalé : CN, CO2, NH2, CO, CH = CH, NO2, I. Quand un
d'entre eux se trouve isolé dans une molécule, sa présence ne suffit pas à
entraîner le métal paramagnétique dans un ion complexe. Il faut que son
existence se trouve répétée plusieurs fois dans la constitution de l'ion
complexe ou que lui soit adjoint un ou plusieurs autres groupements tels que
ceux cités précédemment. La dissimulation du métal dans l'ion complexe dépend
d'autre part non seulement du nombre mais des positions respectives des
différents atomes dans l'espace. Aussi les anions complexes donnés par deux
acides isomères stéréochimiques sont de complexité différente.
Au cours de ce travail,
nous avons préparé et mis en évidence l'existence des anions complexes
suivants et mesuré ce que nous avons nommé leur complexité, chiffre mesurant
la plus ou moins grande dissimulation d'un atome paramagnétique dans le
radical :
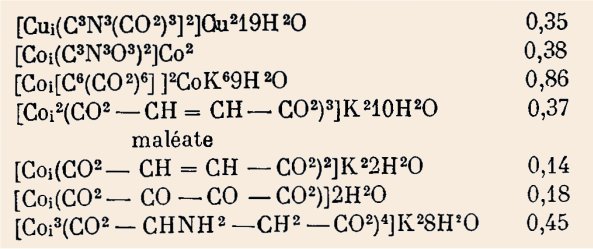
La simplicité de cette
méthode, dans le cas fréquent où les réactifs chimiques sont insuffisants à
classer les ions complexes, permet rapidement de mesurer la complexité des
corps étudiés. De plus, il est facile d'obtenir ainsi une idée de la
constitution d'un corps solide, même insoluble sans le sou-mettre à aucun
traitement chimique qui vienne l'altérer, propriété précieuse pour peu que ce
corps n'existe qu'en faible quantité.