Thèse de
physique présentée à la Faculté des sciences de l'Université de Paris
pour
obtenir le grade de Docteur es Sciences Physiques
par
Lin
Che Kin
Contribution
à l'étude spectrale et à la synthèse des phtaléines dissymétriques et de
leurs dérivés
soutenue le
1er juillet 1939
devant la
commission d'examen :
Perrin,
Jean, président
Ramart-Lucas,
Gault, H., examinateurs
INTRODUCTION
On sait l'intérêt qu'a suscité depuis
longtemps l'étude de la structure des phtaléines. Les nombreuses recherches
qui ont été poursuivies afin d'expliquer les changements de couleur, et, par
suite de structure, que présentent ces substances suivant les conditions dans
lesquelles elles se trouvent, ont conduit à des interprétations parfois très
différentes.
Selon Bernthsen, l'apparition de la
coloration de la phénolphtaléine en milieu alcalin est expliquée par la
formation d'un composé quinonique avec ouverture de la chaîne lactonique
selon le schéma :

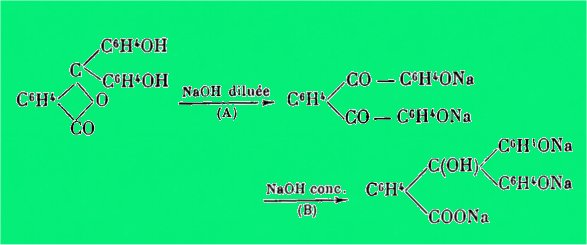
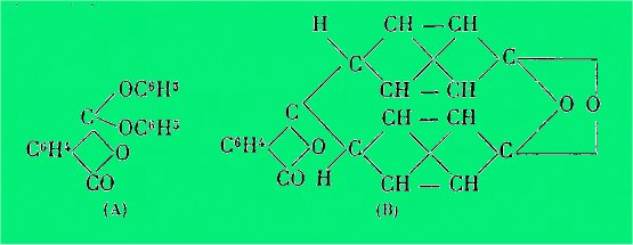
D'après H. Meyer, cette coloration ne
peut s'expliquer que par une transposition intramoléculaire conduisant au
produit dicétonique selon (A) et l'auteur s'explique la décoloration de la
phénolphtaléine en solution dans NaOH concentrée par la formation d'un
composé carbinolique selon (B).
Waddell ayant attribué, en 1899, la
coloration des sels de la phénolphtaléine à un phénomène d'ionisation. Green
montra, par une étude chimique, que cette conception ne pouvait être admise.
Récemment, des mesures spectrales ont
permis à Mme Ramart de mettre en évidence le fait que l'ionisation ne modifie
pas l'absorption de façon sensible.
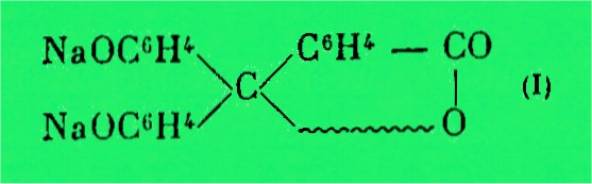
Plus tard, en 1906, Baeyer appliquait
aux phtaléines sa conception de la valence carbonium. L'auteur pensait que la
coloration des phtaléines est due à la présence d'une valence aisément
ionisable qu'il représente par une ligne brisée, c'est ainsi qu'il attribue
au sel coloré de la phtaléine la forme 1 :
Gomberg expliquait l'action des alcalis
sur la phénol-phtaléine par les séries de transformations II, III, IV, V.
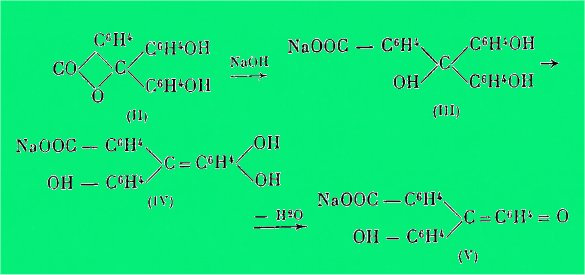
Cette interprétation étant une
conséquence directe de la théorie du quinocarbonium du même auteur.
D'après
Acrée, la coloration de la phénolphtaléine est due à la formation d'un
quinophénate, tandis que Frasmann attribue la couleur des phtaléines à un
équilibre céto-énolique :
Mme
Ramart, à la suite de l'étude des spectres d'absorption des dérivés hydroxylés
du triphénylméthane, des phénols-sulfones phtaléines et des phtaléines, a
montré que les formes colorées de ces trois séries de produits ont les mêmes
spectres (compte tenu de la présence de certains substituants) et par suite les
mêmes structures. Il s'ensuit que, étant donné, d'une part, que la benzaurine
ne peut avoir les constitutions proposées par H. Meyer et Acrée et que, d'autre
part, les tétrabromophénolphtaléines ne peuvent exister sous la forme énolique,
les hypothèses émises par ces auteurs ne peuvent être retenues.
Par
ailleurs, Bernardo Oddo, n'ayant pas constaté la présence d'H mobiles dans la
phénolphtaléine par le réactif de Grignard (méthode Zéréwitinoff), propose deux
formules nouvelles pour représenter la structure de cette substance : (A) ou
(B).
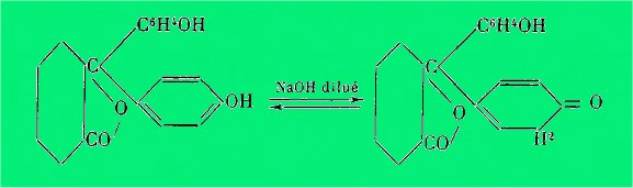
L'analyse spectrale des phénols-sulfones-phtaléines et des
phtaléines a permis à Mme Ramart de montrer que ces substances peuvent exister
sous trois formes isomères transformables l’une en l'autre réversiblement, une
forme lactonique incolore (I) et deux formes colorées (A) et (B).
L'une de ces formes colorées (A)
possède le même spectre et par suite la même structure que la fuchsone. Enfin
les phtaléines peuvent prendre en milieu fortement alcalin la forme
carbinolique (III). Dans le cas des phénols-sulfones-phtaléines, on peut
représenter ces diverses transformations par ces schémas :
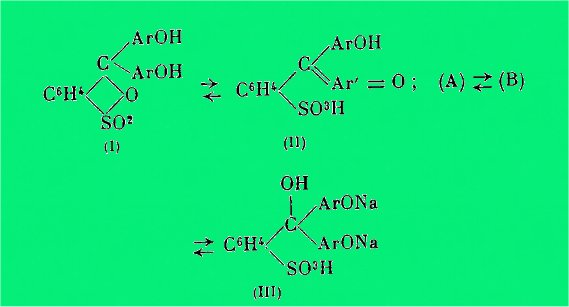
L'isomérie
entre les formes (A) et (B) ne peut s'exprimer par les formules habituelles.
Mme Ramart pense que la différence
d'absorption entre ces deux isomères peut être attribuée au fait que les
angles valentiels de certains atomes ne sont pas les mêmes dans les deux
formes.
Les présentes recherches constituent une
contribution à la synthèse et à l'étude spectrale des phtaléines
dissymétriques.
Si les phtaléines symétriques ont été
très étudiées, par contre, les recherches qui concernent les combinaisons
dissymétriques sont assez restreintes.
Baeyer a nommé les produits de
condensation de l'acide benzoylbenzoïque avec les ortho, méta et para,
diphénols, les phtaléines; l'auteur donnait à ces phtaléines, en solution
alcaline, les formules suivantes :
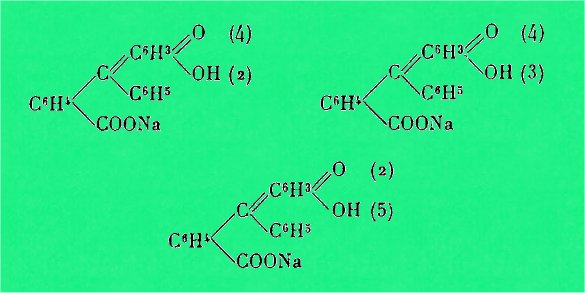
En 1917, Orndorff a préparé le premier
une phtaléine contenant deux noyaux phénoliques différents, et à laquelle il
a donné le nom de phénolrésorcinephtaléine. L'auteur a donné une seule forme
quinonique suivante :

L'intérêt des recherches que j'ai
entreprises consistait non seulement à établir des méthodes permettant
d'obtenir aisément ces substances, jusqu'ici peu accessibles, mais encore à
suivre, par l'analyse spectrale, les diverses transformations qu'elles sont
susceptibles de subir suivant les conditions dans lesquelles elles se
trouvent.
Il était en effet à prévoir, et c'est
ce que l'expérience a confirmé, qu'en faisant varier la nature et la position
des substituants sur les noyaux aromatiques, l'équilibre entre les diverses
formes que peuvent prendre les phtaléines serait modifié.
Les méthodes utilisées jusqu'ici pour
obtenir les phtaléines dissymétriques consistaient à condenser les acides
o-benzoyl-benzoïques avec des phénols au moyen de l'acide sulfurique
concentré ou par simple chauffage.
Or, au cours de ces réactions, il se
forme toujours beaucoup d'impuretés et il est difficile de purifier les
produits obtenus.
J'ai mis au point un procédé qui m'a
permis de préparer très aisément à l'état pur, et avec de bons rendements, la
plupart des substances que j'ai étudiées et qui, pour la plupart, n'avaient
pas encore été signalées.
L'étude même des corps de la série des
acides orthobenzoylbenzoïques qui servent de matières premières pour préparer
les phtaléines dissymétriques m'a permis de faire d'intéressantes remarques
en ce qui concerne la structure de ces substances.
Le fait que, d'une part, les acides de
la série o-benzoylbenzoïque peuvent donner deux sortes d'éthers :
cétoniques (I) et lactoniques (II) et que, d'autre part, les chlorures de ces
acides traités par des carbures aromatiques en présence de chlorure
d'aluminium donnent des diarylphtalides, a conduit MM. J. Bredt, A. Haller et
Guyot, H. Meyer et Orndorff à admettre que ces acides ont, non pas la
structure cétonique (III), mais la forme oxylactonique (IV).
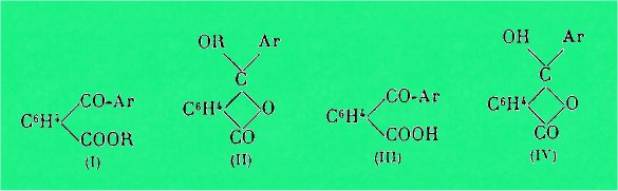
C'est ainsi que MM. A. Haller et Guyot
représentent la formation du diphénylphtalide par la réaction de Friedel et
Crafts selon (A) et que H. Meyer interprète l'éthérification des acides selon
(B) :
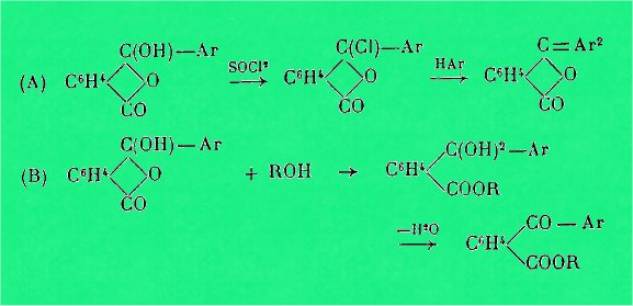
L'observation
faite par Mme Ramart-Lucas que l'introduction d'un OH sur un carbone méthanique
ne modifie pas de façon sensible l'absorption (dans l'ultraviolet moyen) des
corps organiques, m'a permis d'établir que, en solution, les acides o-benzoylbenzoïques
sont surtout sous forme cétonique et que, si les deux formes sont présentes,
comme on est forcé de l'admettre, la forme oxylactonique ne s'y trouve qu'en
faible quantité.
L'observation
faite par Oddo concernant les hydrogènes mobiles présentait un grand intérêt
car, si elle se trouvait exacte, la structure des phtaléines, telle qu'on la
représente, devenait très discutable. J'ai repris ces recherches et j'ai
constaté que les hydrogènes des fonctions phénols réagissent normalement
vis-à-vis des magnésiens. L'erreur de ce savant est sans doute due à un mauvais
choix du solvant employé dans la méthode de Zéréwitinoff.
Les
mesures d'absorption des phtaléines dissymétriques en solution alcaline à des
concentrations variées m'ont permis de déterminer diverses transformations de
ces substances. J'ai en particulier observé que les phtaléines colorées en
solution alcaline concentrée subissent toutes une transformation plus ou moins
complète qui conduit à des corps carbinoliques incolores et que la formation
des dérivés carbinoliques est d'autant plus difficile, c'est-à-dire que la
forme quinonique est d'autant plus stable, que les deux noyaux benzéniques sont
plus substitués. J'ai également constaté que certaines des phtaléines
dissymétriques subissent une décomposition par scission de la molécule, que
d'autres résistent et que cette décomposition est très accentuée pour les
phtaléines qui possèdent un groupement résorcine et surtout un groupe
pyrocatéchine.
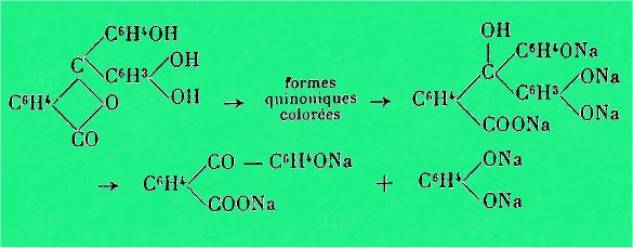
J'ai
observé en plus, par les mesures spectrales, que les phtaléines dissymétriques
qui possèdent plus de deux OH phénoliques répartis sur les deux noyaux
benzéniques, donnent en solution alcaline, un mélange des deux isomères
susceptibles de se former suivant la réaction :
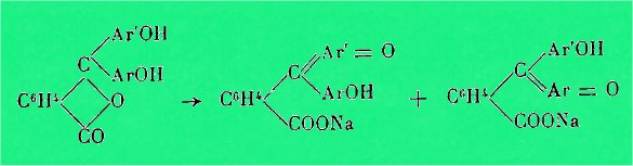
La possibilité pour les phtaléines de donner des corps
quinoniques colorés dans les alcalis est liée à l'existence d'au moins deux
groupes OH phénoliques, lesquels peuvent être fixés sur le même radical
aromatique.
Une
étude comparative des spectres d'absorption des phtaléines et des phtalides
dissymétriques m'a permis d'observer, d'une part, l'influence de la substitution
d'un H dans certains corps organiques que j'ai préparés, dans diverses
conditions, par Na, ONa, OH, CH3, OOC — CH3, OCH3. etc... et des groupements
aryles divers et, d'autre part, les variations absorption des phtaléines
dissymétriques colorées en fonction de certaines conditions telles que : la
concentration de la solution alcaline, la concentration moléculaire du produit
dis-sous, et le vieillissement. De plus, j'ai pu déterminer les meilleures
conditions de stabilité de la forme quinonique des phtaléines dissymétriques.
L'exposé
de ce travail est divisé en trois parties. La première est réservée à la
préparation et à la purification des acides aroylbenzoïques, des phtalides
méthoxylés et des phtaléines dissymétriques.
La
seconde est consacrée .aux dosages des hydrogènes mobiles des phtaléines par le
réactif de Grignard.
Dans
la troisième, la plus importante, se trouve l'étude des spectres d'absorption
dans ultraviolet moyen et dans le visible de tous les corps que j'ai préparés.
CONCLUSIONS
Les principaux résultats obtenus au
cours des recherches qui viennent d'être exposées peuvent être ainsi résumés.
La réaction de Friedel et Crafts telle
qu'elle était utilisée jusqu'ici pour préparer des acides aroylbenzoïques
méthoxylés ne permettait d'obtenir ces substances qu'à l'état très impur (il
se produisait une déméthylation partielle) et avec de mauvais rendements.
En modifiant les conditions
expérimentales (température, solvant...), je suis arrivé à obtenir ces
substances à l'état pur et avec des rendements qui varient de 60 à 92 %.
De même, j'ai pu établir une méthode
simple permettant de préparer des dérivés de diphénylphtalides et des
phtaléines dissymétriques à l'état pur et avec d'excellents rendements. Grâce
à cette méthode, j'ai pu faire la synthèse de toute une série de corps
nouveaux dont la préparation n'avait pas été réalisée pour la raison qu'il
eût été difficile de les obtenir par d'autres procédés.
Les recherches concernant l'étude
chimique et spectrale des solutions des acides ortho-benzoylbenzoïques, des
phtalides et des phtaléines dissymétriques m'ont permis de préciser des
structures jusqu'ici encore très discutées et de déterminer l'absorption de
séries de substances qui n'avaient pas encore été étudiées de ce point de
vue.
C'est ainsi que j'ai pu établir en
particulier :
1° que les acides o.benzoylbenzoïques
ainsi que les acides o.aroylbenzoïques possèdent en solution surtout
la structure cétonique et non pas la forme oxylactonique proposée par J.
Bredt, A. Haller, H. Meyer et Orndorff;
2°
que la phénolphtaléine en solution alcaline n'est pas sous la forme dicétonique
comme le supposait H. Meyer, mais qu'elle est bien quinonique, comme on le
pense ordinairement ;
3° la
coloration intense des phtaléines ne se produit pour tous les cas étudiés que
si elles contiennent au moins deux fonctions phénol, lesquelles peuvent être
fixées sur le même radical aromatique.
4°
Contrairement aux résultats obtenus par Oddo concernant la présence des
hydrogènes mobiles dans les molécules de phénolphtaléine, j'ai établi que
toutes les phtaléines contiennent le nombre d'hydrogènes mobiles correspondant
aux formules qui leur sont ordinairement attribuées, ce qui permet d'écarter
les schémas proposés par Oddo pour représenter la phénolphtaléine.
En ce
qui regarde les conclusions que l'on peut tirer des mesures d'absorption
effectuées sur les phtaléines, j'indiquerai en particulier celles qui
concernent leur structure.
La
stabilité des différentes formes que peuvent prendre les phtaléines suivant les
conditions dans lesquelles elles se trouvent varie non seulement avec le
solvant, la température, le pH, mais aussi avec la structure du reste de la
molécule. La ramification des radicaux alcoyles présents sur les noyaux
aromatiques et la présence des groupes —OH stabilisent la forme quinonique
colorée, l'influence stabilisante exercée par un groupe — OH phénolique est
beaucoup plus accentuée que celle d'un groupe alcoyle. Si on méthyle le croupe
phénolique, l'influence stabilisante diminue.
L'existence
de deux fonctions phénoliques sur un même noyau aromatique dans la molécule des
phtaléines provoque une scission plus ou moins facile de la molécule en
solution alcaline concentrée et c'est toujours le diphénol qui est libéré.
L'introduction
d'une fonction phénol dans la molécule des phtaléines influe beaucoup sur la
coloration en milieu alca-lin ; d'ailleurs la position de l'oxhydrile
phénolique introduit par rapport aux autres chromophores n'est pas indifférente
: j'ai observé que le rapprochement de 2 oxhydriles phénoliques chez les
phtaléines en solution alcaline produit un effet bathochrome et l'éloignement
de ces 2-OH phénoliques produit un effet inverse.
Lorsque le groupe
quinonique peut, sur une même molécule, se trouver engagé dans deux noyaux
aromatiques comme c'est le cas pour des phtaléines dissymétriques, il semble
toujours qu'il se forme un mélange d'isomères.
Au cours de ce
travail, j'ai obtenu les corps suivants qui, à ma connaissance, n'avaient pas
encore été signalés :
1. Acide o-(méthyl-4-thymoyl)-benzoïque.
2. Acide o-thymoylbenzoïque.
3. Ether diméthylique lactonique
de la phénolthymolphtaléine.
4.
Phénol-(méthyl-4-thymol)-phtalide.
5. Ether diméthylique lactonique
de la thymolphtaléine.
6. Ether triméthylique lactonique
de la phénolrésorcine-phtaléine.
7. Ether triméthylique lactonique de la
phénolpyrocatéchinephtaléine
8. Ether triméthylique lactonique
de la phénolhydroquinonephtaléine.
9. Ether triméthylique lactonique
de la thymol pyrocatéchinephtaléine.
10. Ether triméthylique lactonique
de la thymolrésorcinephtaléine.
11
(Méthyl-4-thymol)-pyrocatéchinephtaléine.
12.
(Méthyl-4-thymol)-résorcinephtaléine.
13. Phénolthymolphtaléine.
14. Triacétatede
phénolpyrocatéchinephtaléine.
15. Phénolhydroquinonephtaléine.
16. Thymolpyrocatéchinephtaléine.
17. Thymolrésorcinephtaléine.
18. Benzènepyrocatéchinephtaline.
19. Phénolthymolphtaline.
20. Phénoirésorcinephtaline.
MOTS CLEFS :
structure / lactonique / phénol / quinonique / phénolphtaléine / étude / recherche / condition
/ coloration / meyer / méthode / triméthylique / transformation / ramart / phtaléine / thymol /
rendement / réaction / phtalide / formule / sulfone / oxylactonique / orndorff / haller /
concentration / benzoylbenzoïque / zéréwitinoff / synthèse / résultat / oxhydrile / observation
/ ionisation / interprétation / grignard / friedel / couleur / perrin