Thèse
de chimie organique présentée à Faculté des sciences de Lyon
pour
obtenir le grade de Ingénieur-Docteur
par
¶
Jacques
Massicot
Les
réactions de transfert d'hydrogène dans la série des flavones
soutenue
le 5 mars 1955
devant
la commission d'examen :
Prettre,
M., président
Colonge, J., Mentzer,
C., examinateurs
INTRODUCTION
Dans le cadre
de l’étude effectuée au laboratoire sur les dérivés flavoniques naturels, nous
avons cherché à élaborer des méthodes générales permettant de transformer les
flavones en flavanones et réciproquement.
Prenant la
dihydroxy-5-7 flavone (chrysine) comme exemple, nous avons mis au point une
méthode de réduction sélective utilisant un donneur d'hydrogène
(tétrahydronaphtalène) en présence de noir de palladium. Toutefois, lorsque
nous avons tenté de réduire d'autres flavones, nous avons constaté que les
résultats étaient différents suivant la nature et la position des
substituants : dans certains cas on hydrogène uniquement la double liaison
en 2-5, dans d'autres on ouvre également l'hétérocycle (formation d’une
dihydrochalcone) :
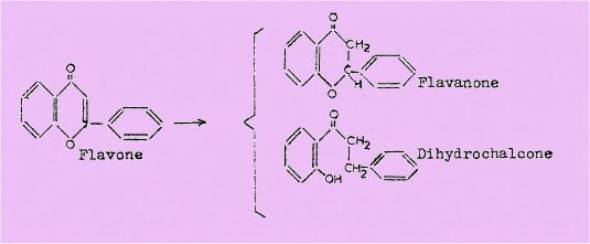
Il arrive également que la réaction d'hydrogénation n'ait pas lieu. Devant ces résultats, nous avons alors effectué la synthèse d'un certain nombre de flavones que nous avons ensuite réduites afin d'essayer de tirer des règles générales sur la stabilité de l'hétérocycle et de la double liaison en 2-5 en fonction de la structure- de la molécule.
D’autre part,
en vue de déterminer dans quelle mesure ces réactions étaient spécifiques du
noyau g-pyronique, nous avons également réduit
quelques benzal-2 coumaranones-3, ce qui permettait de comparer la faculté
d'hydrogénation de la double liaison selon qu'elle est intra- ou
juxta-nucléaire, ainsi que la stabilité relative du noyau flavone (ou
flavanone) et du noyau coumaranone. En effet, comme dans le cas des flavones,
l'hydrogénation des benzal-coumaranones s'effectue avec ou sans ouverture de
l'hétérocycle :
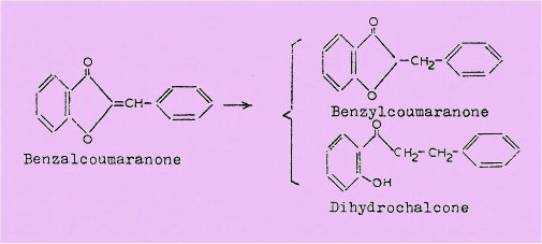
Mais les règles
de structure conditionnant l’orientation de la réaction sont différentes de
celles que l'on peut déduire de la réduction des flavones.
Parallèlement
aux réductions, une méthode de transformation des flavanones en flavones a
également été mise au point, par chauffage avec du noir de palladium, en présence ou non
d'un accepteur
d’hydrogène (cinnamate d’éthyle).
Enfin dans une
dernière partie nous avons proposé un essai d'explication théorique des
résultats obtenus et nous avons indiqué des exemples de cas où ces méthodes d'hydrogénation
et de deshydrogénation
pourraient être mises à profit pour déterminer la structure de certains composés
naturels (flavones ou coumaranones).
Conclusion
Dans la première partie de ce travail nous avons décrit brièvement la synthèse
d'un certain nombre de flavones, effectuée selon des méthodes connues.
Dans
la deuxième partie nous avons mis au point et généralisé la réduction des
flavones au moyen d'un donneur d'hydrogène tel que la tétraline en présence
de noir de palladium. L'étude de cette réaction dans le cas de la
dihydroxy-5-7 flavone nous a montré que :
1)
II y a transformation de la flavone en flayanone par réduction sélective de
la double liaison), selon une réaction équilibrée.
2)
La réaction peut se produire également, bien qu'avec un rendement assez
faible, en l’absence de catalyseur.
Nous
avons ensuite appliqué aux autres flavones et aux benzal-2 coumaranones-3 ce
procédé de réduction utilisant la tétraline en présence de noir de palladium,
ce qui nous a permis d’en tirer les conclusions suivantes : contrairement aux
autres agents de réduction, celui-ci laisse intact le groupement carbonyle
mais dans certains cas il provoque également l'ouverture de l’hétérocycle. On
peut ainsi accéder à des dihydrochalcones qu'il serait parfois assez
difficile de préparer directement. Bien qu'étant moins répandues dans la
nature que les dérivés flavoniques, ces dihydrochalcones sont néanmoins
intéressantes car certaines d'entre elles, telles que la phlorétine ou
pentahydroxy-3-4-2’-4’-6’ dihydrochalcone possèdent des propriétés
biologiques (comme antibiotique, vitamine P etc...)
Dans
le cas de la quercétine (pentahydroxy-3-5-7-3’-4’ flavone), qui n'est pas
réduite par la tétraline en présence de noir de palladium, nous avons montré
que la réaction d'hydrogénation pouvait se produire en utilisant un autre
donneur d'hydrogène (tétrahydroquinoléine) ; cette différence de comportement
dépend sans doute de la coadsorption sur le catalyseur, du donneur et de
l'accepteur d'hydrogène.
Nous avons
également tenté de réduire la quercétine en utilisant la tétraline comme
donneur d'hydrogène, en l'absence de catalyseur, mais nous n'avons alors obtenu
qu'un produit d'addition entre la flavone et l'hexahydronaphtalène
(vraisemblablement par suite d'une synthèse diénique).
Dans
une troisième partie, nous avons décrit une nouvelle méthode de
déshydrogénation des flavanones ou des chalcones en flavones, par chauffage
avec du noir de palladium: en présence de ce catalyseur et à 220°, on a
généralement équilibre entre la flavone et la flavanone, à moins que
cette dernière soit très facile à hydrogéner, auquel cas on obtient alors
un mélange de flavone et de dihydrochalcone. Par contre, la présence
d'un groupement hydroxyle en 4’ provoque la déshydrogénation complète des
flavanones, même lorsqu'on opère dans la tétraline, ce qui
explique que nous n'ayons pu réduire les flavones correspondantes.
Dans
la dernière partie nous avons rassemblé et comparé les résultats obtenus et
nous avons tenté de fournir une explication théorique des faits
observés:
La
réduction des flavones n'ayant pas de groupements hydroxyles libres sur le
noyau phényle conduit selon les cas à une flavanone ou à une
dihydrochalcone. Pour expliquer cette différence de comportement nous avons
fait intervenir la possibilité de stabilisation de la molécule par formation
d'une liaison hydrogène entre le groupement carbonyle et le groupement
hydroxyle créé en ortho par l'ouverture de l'hétérocycle. On pourrait ainsi
rendre compte du fait que la réduction des flavones ayant déjà un groupement
hydroxyle en a du groupement carbonyle (position 5) s'arrête au stade
flavanone et que d'autre part les substituants favorisant l'ionisation
du groupement carbonyle (donc la formation d'une liaison hydrogène)
facilitent l'ouverture de l'hétérocycle.
Dans
le cas des dérivés ayant des groupements hydroxyles libres en 4' ou
3'-4', la double liaison en 2-3 est fortement stabilisée par la résonnance
entre le groupement carbonyle et les groupements hydroxyles du noyau phényle
ce qui expliquerait qu'alors les flavanones se déshydrogènent
en flavones.
En
comparant ces résultats avec ceux obtenus dans le domaine des coumaranones,
nous avons pu énoncer quelques règles permettant de différencier les flavones
ou flavanones des benzal- ou benzyl-coumaranones.
Enfin, en
remarquant que dans les flavanones qui ont des groupements hydroxyles libres en
4' ou 3’-4’, les atomes d'hydrogène portés par les carbones N° 2 et 3 sont
particulièrement mobiles, nous avons pensé qu'il y avait peut-être là un
rapport avec les propriétés biologiques de ces substances. Nous basant sur les
travaux de Linstead et de ses collaborateurs qui ont montré que les corps capables
de céder leur hydrogène par chauffage en présence de noir de palladium.peuvent
également dans certains cas agir à basse température et sans catalyseur, nous en avons
déduit un mode possible d'action des flavanones dans la protection des
substances facilement oxydables, telles que la vitamine C.
MOTS CLEFS :
antibiotique / atome / benzal / benzyl / carbonyle / catalyseur / chalcone / chrysine / cinnamate
/ coumaranone / déshydrogénation / diénique / dihydrochalcone / flavanone / flavone /
hexahydronaphtalène / hydrogénation / hydroxyle / liaison / linstead / méthode / molécule /
palladium / phényle / phlorétine / propriété / pyronique / quercétine / réaction / résultat /
structure / substituant / synthèse / tétrahydronaphtalène / tétrahydroquinoléine / tétraline /
vitamine / prettre