Thèse présentée à la Faculté des sciences de
l'Université de Paris
pour obtenir le grade de Docteur de l'Université de
Paris
par
M. Martynoff
Relations entre les propriétés chimiques et la
"couleur" des méthoxybenzophénone-oximes et de leurs dérivés
soutenue en novembre 1936
devant la commission d'examen :
Perrin, Jean, président
Ramart-Lucas, Dupont, G., examinateurs
INTRODUCTION
On sait l'intérêt qui s'attache depuis longtemps à l'étude des
oximes. Un grand nombre de recherches, conduisant a des résultats parfois
contradictoires, ont été faites en vue d'élucider les isoméries que
présentent ces substances.
D'après Beckmann, l'isomérie des deux benzaldoximes
serait une isomérie de compensation : l'un des isomères aurait la structure
oxime (I), l'autre la constitution iso-oxime (II).
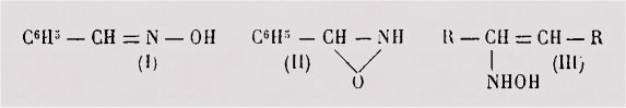
Selon Hantzsch et Werner,
cette isomérie doit être attribuée à un arrangement spatial différent des
atomes ou des radicaux liés au groupe > C = N — :

La formule iso-oxime (II)
fut, peu à peu, abandonnée faute d'avoir pu être démontrée expérimentalement
et la conception stéréochimique de Hantzsch et Werner fut généralement
adoptée.
Signalons encore la
formule "pseudo-oxime" (III) proposée par Mme Raikowa pour les cas
où un seul des isomères prévus par la théorie de Hantzsch et Werner a pu être
isolé (il est, d'ailleurs, a remarquer que celle formule laisse également
prévoir l'existence de deux stéréo-isomères).
Des recherches plus
récentes, effectuées sur les dérivés de substitution des oximes, ont, montré
que, dans plusieurs cas, le nombre des isomères qui ont été trouvés est
supérieur à celui qui peut être prévu par la théorie stéréochimique et que
les propriétés chimiques et spectrales de ces isomères ne s'accordent pas
avec celles qui correspondent aux formules de Hantzsch et Werner.
L'identification des
différents isomères ainsi que la détermination exacte de leur structure par
des méthodes chimiques se trouvent souvent compliquées par des transpositions
intramoléculaires, provoquées par les réactifs, ou bien encore par l'absence
de propriétés chimiques suffisamment sensibles à de faibles différences dans
l'architecture moléculaire.
L'étude de certaines
propriétés physiques, et, en particulier, de l'absorption dans l'ultraviolet
moyen, a permis dans un très grand nombre de cas de préciser les structures
des composés organiques.
On sait, en effet, qu'il
existe une relation étroite entre les propriétés optiques des corps
organiques et leur structure (mode de liaison des atomes dans la molécule et
configuration spatiale).
C'est ainsi, comme je
l'exposerai plus loin, que l'étude de l'absorption de certains dérivés des
oximes m'a conduit à mettre en évidence que ces substances peuvent subir une
transposition intramoléculaire d'une nature spéciale, et qui, à ma
connaissance, n'était pas connue.
En ce qui regarde l'étude
des spectres d'absorption des oximes, rappelons que Mme Ramard-Lucas, avec
Mme Grumez et avec Mme Bruzeau, a mesuré l'absorption d'un grand nombre
d'oximes et a établi que ces substances peuvent exister, non seulement sous
les deux formes prévues par la théorie de Hantzsch et Werner, mais également
sous une autre forme ne possédant pas d'atome de carbone doublement lié, soit
avec l'atome d'azote, soit avec un autre atome de carbone.
Les propriétés optiques
des oximes de la première catégorie (appelées par Mme Ramart-Lucas
«absorbantes») s'accordent avec les formules proposées par Hantzsch et
Werner. Pour les oximes de la seconde catégorie (ou oximes «transparentes»)
la formule iso-oxime ou celle d'un dérivé nitrosé, peuvent convenir l'une et
l'autre du point de vue de l'absorption dans l'ultraviolet ; toutefois, d'une
part, pour des raisons d'ordre chimique et, d'autre part. étant donné leurs
spectres infrarouges, seule la forme iso-oxime a été retenue.
Les mesures d'absorption
dans l'infrarouge, effectuées par Mr et M. Freymann ont, en effet, confirmé
les travaux de Mme Ramart-Lucas. La présence du groupe — NH — dans les oximes
«transparentes» a été observée dans tous les cas étudiés.
En ce qui concerne les
dérivés alcoylés des oximes (appelés improprement, éthers par certains
auteurs), leur étude optique est, un peu moins avancée.
Mme Ramart-Lucas a
constaté avec J. Hoch (expériences inédites) que les dérivés alcoylés des
oximes, dans lesquels le radical substituant est fixé sur l'atome d'oxygène
du groupe fonctionnel, ont une absorption assez voisine (forme et position des
bandes) de celle des oximes dont ils dérivent. L'étude de l'absorption des
oximes N-substituées permet de conclure, dans beaucoup de cas, à la présence
d'un atome d'azote que l'on considère d'une façon générale comme étant
pentavalent. De plus, lorsque le radical alcoyle fixé à l'azote possède un
groupe CH2 = ou CH = lié directement à l'azote, on observe des variations
d'absorption qui doivent être attribuées à une migration de la double liaison
azote
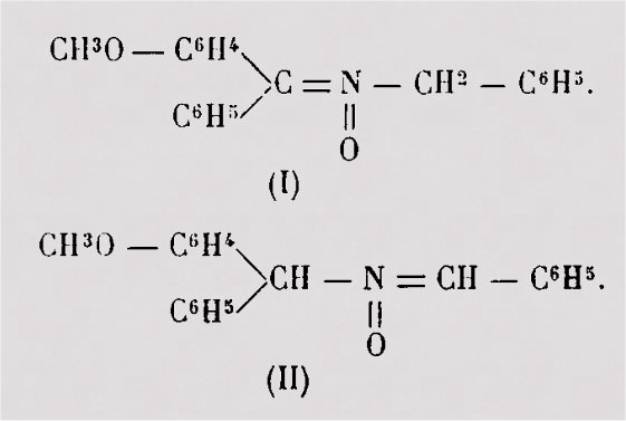
Je citerai, à titre d'exemple, le dérivé N-benzylé de la
benzophénone-oxime dont on connaît les deux formes isomères qui peuvent être
identifiées par des mesures d'absorption :

O. Lisle Brady, au cours
d'une étude sur l'absorption des dérivés alcoylés de certaines oximes, avait
depuis longtemps été conduit a envisager dans ces substances la présence d'un
atome azote pentavalent.
Il est assez intéressant
de noter que, pendant très longtemps, les formules à oxygène pontal furent
les seules admises pour la représentation des N-alcoyl-oximes. D'après les travaux
plus récents, ces formules ne seraient applicables qu'à quelques cas
particuliers, notamment aux dérivés alcoylés des oximes de cétones a-trisubstituées.
Néanmoins, certaines
transformations que subissent les dérivés des oximes paraissent impliquer
l'apparition intermédiaire de la forme de Beckmann et permettent de préjuger
de son existence de façon plus générale.
Dans le présent travail,
j'apporte une contribution à l'étude de la constitution et du comportement
chimique des. oximes de ce tories diarylées dissymétriques et de leurs
dérivés.
J'ai préparé, a l'état
aussi pur que possible, les ortho-, méta- et paraméthoxybenzophénone-oximes
et leurs dérivés benzylés.
J'ai étudié, par des
méthodes chimiques et par des déterminations de spectres d'absorption, la
structure et la configuration spatiale des différents isomères, les
transformations qu'ils peuvent subir sous l'action de certains réactifs et
l'influence qu'exerce, sur leur comportement chimique, un groupe — OCH3
suivant la place qu'il occupe sur l'un des noyaux benzéniques voisins du
groupement fonctionnel.
J'ai étudié également les
stéréomutations que ces substances sont susceptibles de subir lorsqu'elles
sont soumises a l'influence des rayons ultraviolets.
J'ai constaté, en
particulier, au cours de mes recherches, que les produits N-substitués,
obtenus dans la benzylation des méthoxybenzophénone-oximes, ne sont pas les
dérivés N-benzylés normaux mais des produits de transposition qui doivent
être considérés comme dérivant de la benzaldoxime.
J'ai pu montrer, en outre,
que les réactions d'hydrolyse, utilisées depuis longtemps pour la
détermination de la structure des dérivés des oximes, sont, dans certains
cas, précédées par des phénomènes de transposition et conduisent à des
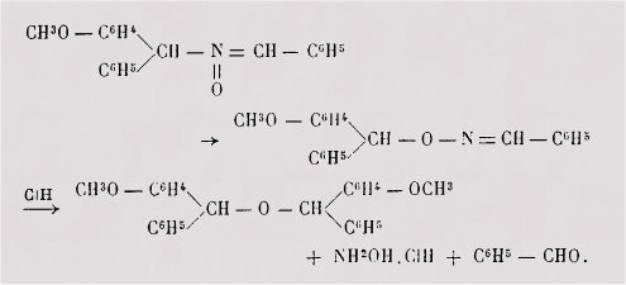
résultats qui paraissent, a première vue, contradictoires. Ainsi, lorsque
l'on fait agir l'acide chlorhydrique aqueux sur la N -
(orthométhoxybenzhydryl) - benzaldoxime, on obtient, à côté de la
benzaldéhyde, non pas le chlorhydrate de la N-(orthométhoxybenzhydryl)-hydroxylamine,
mais le chlorhydrate de l'hydroxylamine non substituée et l'oxyde de
l'ortho-méthoxybenzhydryle. La formation de l'hydroxylamine non alcoylée
provient du fait que, au cours de l'action de l'acide chlorhydrique sur le
dérivé N-substitué initial, celui-ci subit une transposition en dérivé
0-substitué correspondant plus aisément hydrolysable.
Les faits observés peuvent
être résumés par le schéma suivant :.
Par conséquent, la
formation d'hydroxylamine dans l'hydrolyse d'une alcoyloxime ne permet pas
toujours d'affirmer que le produit de départ est un dérivé O-substitué.
Les méthodes
d'alcoylation, dont on se sert couramment pour la préparation des dérivés des
oximes, aboutissant à un mélange de différents isomères, ne donnent que peu
d'indications sur leur constitution. Dans la mesure du possible, afin de
fixer avec plus de certitude la structure des produits obtenus par
alcoylation des oximes, j'ai réalisé la synthèse de ces corps par une autre
méthode.
L'étude de l'absorption a
nécessité la préparation des oximes et de leurs dérivés à l'état de très
grande pureté.
Lorsque le produit
présentait un point de fusion ou un point d'ébullition invariables, on
effectuait la première mesure ; on poursuivait ensuite les cristallisations
ou les distillations, jusqu'à ce que le spectre ne soit plus modifié.
CONCLUSIONS
Afin d'apporter une
contribution à l'étude des propriétés chimiques et spectrales des
diarylcétoximes dissymétriques et de leurs dérivés O- et alcoylés, j'ai
préparé, à l'état aussi pur que possible, les méthoxybenzophénone-oximes et
leurs dérivés benzylés.
Dans la première partie de
ce travail, relative a la préparation et à la purification des oximes, j'ai
décrit la synthèse d'un certain nombre de ces .substances, effectuée par des
méthodes autres que celles qui avaient été utilisées jusqu'ici. Parmi ces
synthèses, je citerai celles qui consistent à obtenir les oximes par action
de l'hydroxylamine sur les cétimines correspondantes et la préparation des
méthoxybenzophénones effectuées en traitant les chlorures des acides
méthoxybenzoïques par les dérivés organozinciques mixtes.
Jusqu'ici, la réaction de
Friedel et Gratis a été la seule utilisée pour l'obtention des
méthoxybenzophénones. Elle présentait l'inconvénient de donner des rendements
assez faibles, car une partie de la cétone était déméthylée au cours de la
réaction et passait à l'état d'oxybenzophénone.
Dans la deuxième partie,
la plus importante, j'ai décrit la préparation, la purification et l'étude
chimique des dérivés benzylés des méthoxybenzophénone-oximes.
J'ai observé que l'action
du chlorure de benzyle sur les mélhoxybenzophénone-oximes, en présence
d'éthylate de sodium, conduit à la formation de deux dérivés isomères, dont
l'un est substitué à l'oxygène et l'autre à l'azote.
La constitution des
O-benzyl-oximes des méthoxybenzophénones a été établie au moyen de leurs
synthèses effectuées en condensant les cétones ou les cétimines avec 1
'O-benzylhydroxylamine.
La structure des dérivés
N-substitués, dont les synthèses sont souvent difficiles à réaliser, a été
déterminée, d'une part, à l'aide de certaines réactions telles que
l'hydrolyse chlorhydrique et la réduction au moyen du sodium et de l'alcool
absolu et, d'autre part, par la mesure de leur absorption.
Cette étude chimique a
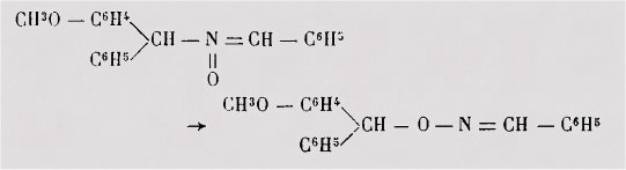
montré que les produits N-substitués obtenus dans la benzylation des
méthoxybenzophénone-oximes n'étaient pas des dérivés N-benzylés normaux, mais
des produits de transposition résultant d'une migration d'un hydrogène avec
déplacement de la double liaison :

J'ai, en effet, constaté
que l'hydrolyse des N-alcoyl-oximes conduit, dans certains cas, à la
formation de l'hydroxylamine non substituée, ce qui s'explique par la
transposition, sous l'action de l'acide chlorhydrique, du dérivé N-alcoylé
initial en dérivé O-alcoylé correspondant plus aisément hydrolysable. A ma
connaissance une telle transposition n'avait pas encore été observée.
J'ai constaté que la
réduction à l'aide du sodium et de l'alcool absolu permet également d'établir
une distinction entre les oximes O- et N-substituées.
De même que les oximes
dont elles dérivent, les O-alcoyl-oximes donnent par réduction des aminés
primaires. Il y a une coupure entre les atomes d'azote et d'oxygène du
groupement fonctionnel.
Par contre, les N-alcoyI-oximes
conduisent, dans ces conditions, à des aminés secondaires. La forme et la
longueur de la chaîne principale ne sont pas modifiées.
Dans la troisième partie
j'ai décrit les essais de stéréo-mutations photochimiques effectués sur les
méthoxybenzophénone-oximes et leurs dérivés benzylés.
Ici encore, les
comportements des oximes et de leurs dérivés O-benzylés ont été tout a fait
semblables ; pour les deux catégories de corps j'ai obtenu un certain nombre
de résultats positifs.
En ce qui concerne les
N-alcoyI-oximes, il ne m'a pas été possible de mettre en évidence une
stéréomutation. Ces substances se résinifient et se décomposent très
rapidement sous l'action des rayons ultraviolets.
La quatrième partie
comprend l'étude de l'absorption, dans ultraviolet moyen, des produits
décrits dans les parties précédentes.
De même que l'oxime de la
benzophénone, dont elles dérivent, les méthoxybenzophénone-oximes sont
constituées par la forme oxime («forme absorbante»).
Les dérivés O-benzylés ont
une absorption trop voisine de celle des oximes non substituées
correspondantes pour que l'on puisse envisager une différence structurale
quel-conque. Le remplacement de l'hydrogène du groupement fonctionnel par le
radical benzyle provoque une légère augmentation du coefficient d'absorption
et un déplacement faible des bandes vers le visible.
Par contre, l'absorption
des N-alcoyI-oximes diffère beaucoup de l'absorption des oximes et de leurs
dérivés O-substitués. Ce changement dans les propriétés spectrales correspond
à une modification profonde de la structure du groupement fonctionnel.
En ce qui concerne
l'absorption des stéréo-isomères (oximes et 0-benzyl-oximes), j'ai constaté
que les isomères syn et anti ont des couleurs différentes mais les
différences sont faibles et consistent surtout en un déplacement des bandes
et une variation de l'intensité de l'absorption sans qu'il y ait de
modifications sensibles dans la forme des bandes.
Cette dernière
constatation est en accord avec les conclusions des travaux de Mme
Ramart-Lucas et de ses collaborateurs sur le comportement optique des
composés stéréo-isomères.
Au cours de ce travail,
j'ai préparé les composés suivants, qui, à ma connaissance, n'avaient pas
encore été signalés :
Imine de
l'orthométhoxybenzophénone.
0-(benzyl)-orthométhoxybenzophénone-oxime
(syn et anti).
0-(orthométhoxybenzhydryl)-benzaldoxime.
N-(orthométhoxybenzhydryl)-benzaldoxime.
Oxyde de
l'orthométhoxybenzhydryle.
Dérivé acétylé de la
N-(orthométhoxybenzhydryl)-benzyl-amine.
Métaméthoxybenzophénone-oxime.
0-(benzyl)-métaméthoxybenzophénone-oxime.
N-(métaméthoxybenzhydryl)-benzaldoxime.
N-(pararnéthoxybenzhydryl)-benzaldoxime.