Mémoire présenté à la Faculté des sciences de
l'Université de Paris
pour obtenir le grade de Diplôme d'Etudes
Supérieures
Michel Mangane
soutenue en février 1966
par
Sur quelques benzo (c) acridines et benzo (a)
carbazoles porteurs d'un groupement méthyle sur leur région méso-phénanthrénique
devant la commission d'examen :
Quelet, R., président
Amiel, J., Bothorel, P., et Mentzer, C.,
examinateurs
INTRODUCTION
Que ce soit dans le
domaine. de la recherche fondamentale, ou dans celui des larges exploitations
industrielles, les naphtols ont été abondamment utilisés et les articles,
mémoires, monographies ou brevets consacrés à leur étude sont innombrables.
Les naphtols sont présents dans de multiples synthèses : dans le premier cas,
comme bases d'accès à de nombreuses substances polycondensée.
Dans le second comme
matières premières, en vue de l'obtention d'une cohorte de molécules
utilisables dans les domaines biologiques, pharmaceutiques ou encore jouant
un rôle important dans la chimie des parfums et des colorants. Par contre les
dérivés alkylés des naphtols, en particulier les methylnaphtols s'ils sont
tous connus n'ont pas été étudiés d'une façon systématique, du moins quant à
leur propension à fournir des dérivés polycondensés hétérocycliques.
Ainsi il y a seulement
vingt ans que la chimie du methyl-6 naphtol-2 a été quelque peu défrichée,
les difficultés d'accès aux méthylnaphtols sont très variables selon les
positions relatives des substituants OH et CH3 et l'on doit selon les cas modifier
soit le processus de la synthèse soit la nature de la substance de départ et
bien entendu les rendements se répartissent sur une très large échelle.
Ce mémoire sera consacré
aux molécules hétérocycliques polycondensées ; benzocridines et benzocarbazole
issues du méhyl-3 naphtol-1 (I) et du méthyl-4 naphtol-1 (II).
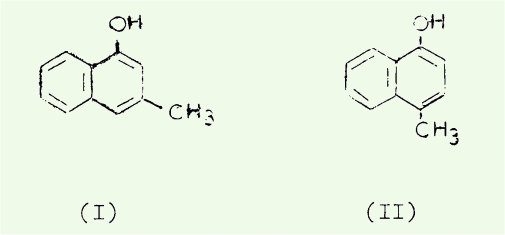
Si (I) nécessite une
préparation assez laborieuse mais chimiquement très intéressante le méthyl-4
naphtol-1 (II) est depuis 1955 d'un accès facile avec un rendement de l'ordre
de 70%, qui contraste avec les 20% signalés dans la littérature en 1914.
Grâce à ces matières premières dans la molécule desquelles les groupements CH
et CH3 se trouvent sur le même cycle nous avons élaboré des substances
appartenant aux familles des benzo (C) acridines (III) et des benzo (a)
carbozoles (IV), et portant un groupement CH3 soit en 5 soit en 6,
c'est-à-dire sur leur région mésophenanthrenique ou région K.
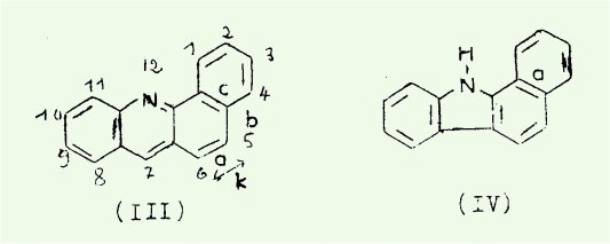
Ces familles étudiées
chimiquement et biologiquement depuis de nombreuses années par l'équipe
LACASSAGNE-BUU-HOI sont particulièrement intéressantes par les
éclaircissements qu'elles ont permis d'apporter sur les relations entre
structure moléculaire et pouvoir cancérogène.
Les benzo (c) acridines
(III) se sont révélées être des cancérogènes puissants contrairement à
laaplupart de leurs isomères les benzo (a) acridines. La synthèse de telles
substances est aisée selon des méthodes classiques modifiées par 1’un de nous
dans le cas des substitutions en position 7.
Nous savons déjà que la
position d'un substituant sur un même noyau de base est susceptible de
modifier certaines de ses activités biologiques. Ainsi dons le cas des méthyl
naphtols (I) et (II) qui nous intéressent, le méthyl-5 naphtol-1 (I), ainsi
que ses dérivés, est doué de propriétés antihémorragiques puissantes alors
que son isomère le méthyl-4-naphtol-l (II) en est totalement dépourvu. Sur
les molécules de type (III) le rôle des substituants est capital (méthyle en
particulier) tant par leur présence que par la position qu'ils occupent. De
plus dzns le cas d'une polysubstitution, les positions relatives des divers
groupements présentent également une grande importance dans l'évolution du
processus cancérogène.
Dans l'exemple
particulier de la répartition des groupements méthyles. sur les molécules des
benzo (a) et (c) acridines, ZAJdELA, BUU-HOI et JACQUIGNON ont montré
l'importance du nombre et de la position de ces groupements méthyles.
Enfin on sait que dans la
molécule (III) la liaison 5,6 où l'on trouve une plus grande concentration
d'électrons, porte le nom de région K, Cette même région sur les
hydrocarbures aromatiques du type benzanthracene, ou même du benzo-pyrène,
joue un rôle notable lors de la fixation de ces carbures sur les protéines
cellulaires. Cette région avait d'ailleurs montré sa réactivité lors de la
fixation du tétroxyde d'osmium. Ces observations ont été énoncées en
particulier par BHARGAVA et HEIDEL-BERGER qui dans le cas du dibenzo (a, h)
anthracene (V) ont prouvé que 25% du cancerogène fixé est uni par la région K
et de plus ils ont isolé au cours de l'expérience des amides de l'acide
phenyl-2 phenanthrene-3,2 dicarboxylique (VI).
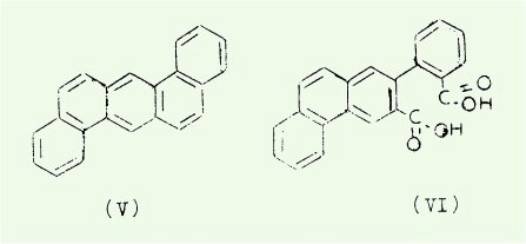
Mme
DAUDEL et ses collaborateurs ont confirmé ces hypothèses par 1'utilisation
des spectres de fluorescence.
Parallèlement des
investigations ont été effectuées pour étudier le pouvoir oncogène des benzo
et dibenzocarbazoles simples et diversement substitués. Citons pour mémoire
les travaux importants de BOYLAND complétés par ceux de LACASSAGNE, BUU-HOI
et leurs élèves.
Les composés du type (IV)
et leurs homologues supérieurs alkylés ou non tiennent une place très
importante dans les familles de substances susceptibles d'apporter des
renseignements très utiles.
L'ensemble de ces
considérations montrent la grande importance de nos composés (I) et (II) en
tant que géniteurs de benzacridines et benzocarbazoles porteurs d'un
groupement méthyle sur leur région K, particularité propre à exalter
certaines propriétés de la. molécule. De plus, l’intérêt chimique de telles
synthèses est grand, compte tenu de la rareté relative de ces substances
ainsi substituées.
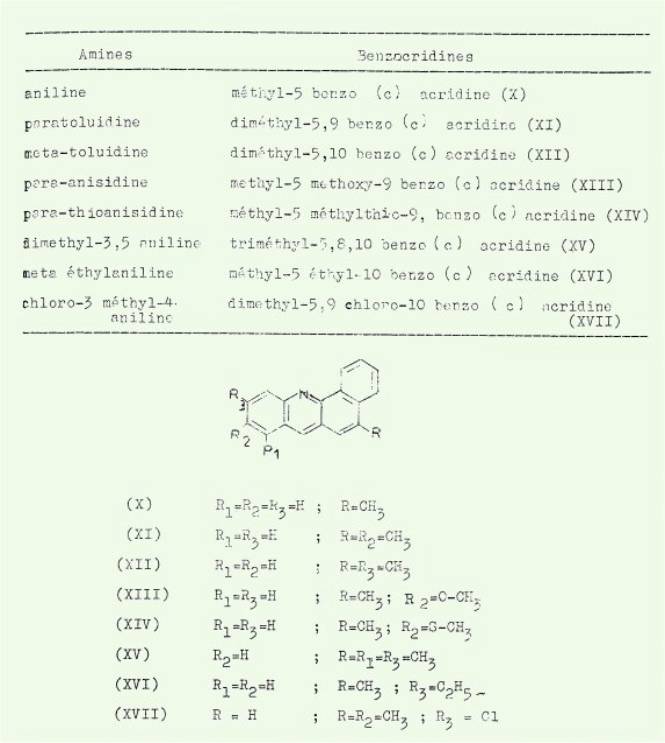
La réaction
d'ULLMANN-FETTVADJAN (condensation d'un naphtol avec une amine primaire en
présence de formaldéhyde) appliquée au méthyl-3 naphtol-1 (I) a permis
d'isoler les benzacridines inscrites dans le tableau 1.
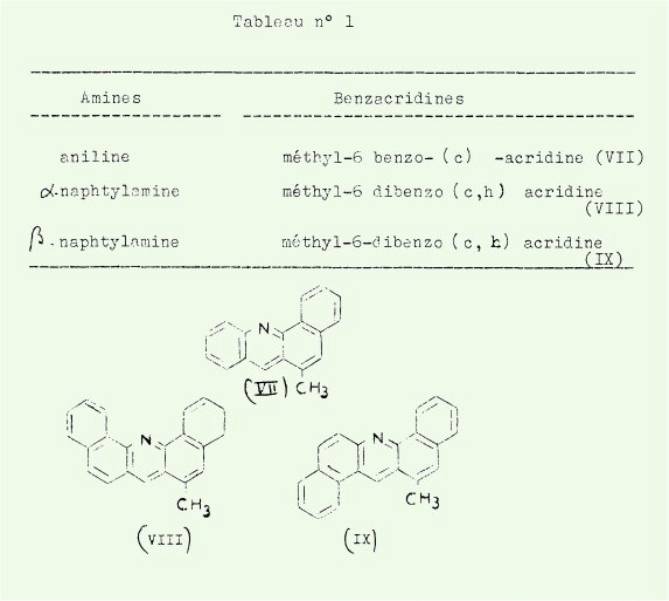
La même réaction
appliquée au méthyl-4-naphtol-l (II) nous a conduit aux benzacridines
consignées dans le tableau n° 2.
Le même à partir de (II)
condensé avec des aminés polynucléaires nous avons pu isoler les hétérocycles
inscrits dans le tableau n°3
Tableau n°3

Une des étapes
intermédiaires de la préparation du méthyl-3 .naphtol-1 (I) consiste en
l'isolement de la méthyl-3 tétralone-1 (XXII) qui avait d'ailleurs été
préparée par BUU-HOI selon une autre méthode.
Cette cétone est
particulièrement intéressante pour la synthèse de méthyl-6 benzo (a)
carbazoles c'est-à-dire de composés substitués sur leur région K.
La méthode utilisée est
la technique d’indolisation selon FISCHER qui comporte un stade intermédiaire
qui après deshydrogénation conduit au benzo (a) cerbazole cherché.
Le tableau n°4 présente
les benzocarbazoles obtenus en condensant la cétone (XXII) (a) avec
différentes arylhydrazines

Il n'a pas été toujours possible d'isoler dans chaque
cas le dihydrobenzo ou le dihydrodibenzo carbazole intermédiaire cependant
dans la plupart des cas les arylhydrazones ont pu être purifiées
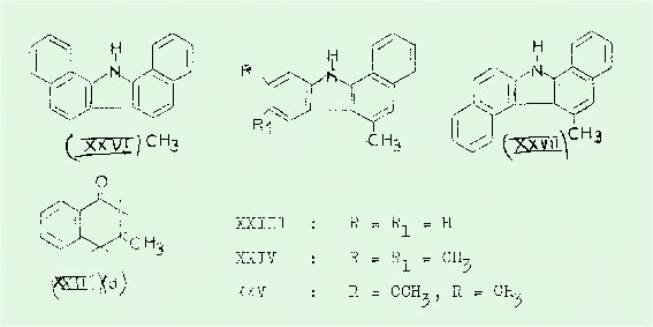
Accessoirement à partir
de la cétone (XXII d) nous avons par oximation et transposition obtenu le
méthyl-3 amino-l naphtalène préconisant ainsi une voie nouvelle en appliquant
une technique que SCHROETER avait utilisée dans d'autres ças.
En ce qui concerne leurs
propriétés physiques les benzacridines ont présenté des points de fusion
assez peu élevés, en outre leurs picrates ont presque toujours fondu beaucoup
plus haut que les bases-mères.
Par contre, dans la série
des benzocarbazoles où les points de fusion sont relativement plus hauts nous
avons dû, pour illustrer nettement la différenciation des deux stades dihydro
et deshydrogénés, avoir recours à la spectrométrie de masse. Cette dernière
méthode a. été appliouée aux trois benzacridines (X), (XI) et (XII) pour
étudier la stabilité de telles molécules, l'importance de la fragmentation
des chaînes et du noyau et enfin l'importance des doubles charges observées.
Ces résultats entrent d'ailleurs dans la cadre d’une étude plus générale
comme compléments de recherches concernant les relations entre la structure
moléculaire et diverses propriétés physiques de membres d'une même famille
mais diversement substitués : en particulier résonance magnétique nu-cléaire
;diffusion Rayleigh de la lumière dépolarisée ; susceptibilité diamagnétique
etc.
Cette prospection
systématique chimique et physique contribuera sans doute de manière efficace
à une meilleure connaissance du processus de cancérisation par les substances
chimiques. Ce domaine quoi qu'on en dise reste un problème de premier plan et
demande les efforts conjugués des diverses disciplines intellectuelles qui forment
la chimie organique moderne et qui se complétent de manière efficace,
cerneront ensemble des questions qu'elles sont incapables de résoudre
individuellement.
Nous diviserons notre
travail de la manière suivante :
Première Partie -
Préparation des matières premières
Deuxième Partie -
Synthèse des benzo ( c ) acridines
Troisième Partie -
Synthèse des benzo (a ) carbazoles
Quatrième Partie - Etude
en spectroscopie de masse
Cinquième Partie -
Conclusion.
Nous avons dans la mesure
du possible respecté et appliqué les règles de l'Union internationale de
chimie pure et appliquée, qui sont énoncées dans le fascicule 10 du Bulletin
de la Société Chimique de France, Octobre 1958.
CONCLUSION
Du travail qui vient
d’être exposé un certain nombre de points ressortent qui constituent les
repères des arguments proposés et des résultats obtenus.
1°) Nous avons préparé des quantités importantes
méthyl-3 naphtol-1 et de méthyl-4 naptole-1 en fusionnant diverses méthodes
déjà décrites afin d’effectuer des synthèses assurant le maximum de
rendement.
2°) a) Ces deux naphtols
ont été des matières premières nécessaires à l'accession à 1a famille des
benzo (c) acridines dont on sait quel rôle important elle joue dans l'étude
des relations entre structure moléculaire et pouvoir cancerogène.
b) De par leur structure
(presence simultanée des groupements OH et CH3 sur le même cycle benzénique)
ces deux naphtols ont permis la synthèse de benzo (c) acridines possédant un
groupe méthyle sur leur région K ou méso phénanthrènique : cette zone
joue un rôle chimique et biologique important et montre l'intérêt de telles
synthèses dans la série précitée. Les benzacridines ont été assez aisément
obtenues (Rendement d'environ 40%) facilement caractérisables et plusieurs
d'entre elles sont actuellement testées biologiquement.
c) La méthy1-3
tétra1one-1, substance intermédiaire dans la synthèse du méthyl-3 naphtol-1
nous a conduit selon une technique éprouvée à des benzo (a) carbazoles
substitués en position 6 et ceci avec des rendements de l'ordre de 30%.
Certains d'entre eux .sont également soumis à des essais. Des observations
ont été faites quant au phénomène de deshydrogénation (spontané ou provoqué)
intervenant avec ces molécules de carbazoles.
3°) Nous avons utilisé la
spectrométrie de masse pour, bien entendu, éclaircir certains points douteux
de nos synthèses, mais aussi, et surtout pour étudier le comportement des
benzo (c) acridine, fragmentation, importance des doubles charges, importance
du processus de deshydrogénation, etc... Cette étude venant compléter les
observations déjà faites dans d'autres disciplines physicochimiques.
4°) Au cours de ce
travail nous avons isolé dix neuf corps qui n'étaient pas encore signalés
dans la littérature.