Thèse de
sciences présentée à la Faculté des sciences de l'Université de Paris
pour
obtenir le grade de Docteur de l'Université de Paris
par
Philippe
Mabille
Problème
de substitution dans la chimie du Chrysène
soutenue
le 27 mai 1960
devant la
commission d'examen :
Amiel,
J., président
Rumpf,
P., Daudel, R., examinateurs
INTRODUCTION
Parmi les hydrocarbures
aromatiques tétracycliques, le chrysène (1) occupe une place importante.
Nous allons en rappeler brièvement les principales raisons.
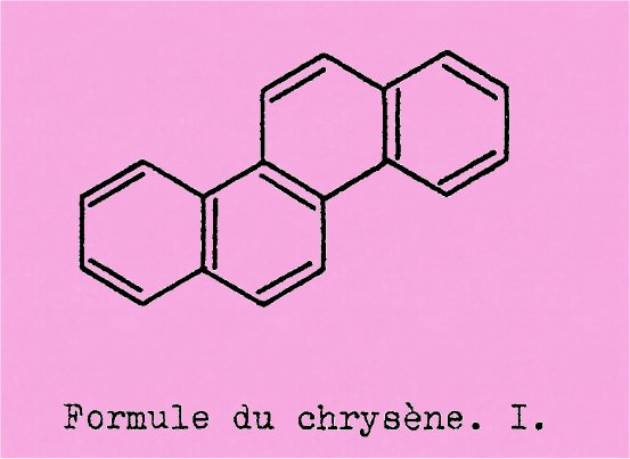
C'est tout d'abord, du
fait, sinon de son abondance, du moins de la multiplicité et de la variété de
ses sources.
Isolé en 1857 par le
chimiste français LAURENT au cours d'un fractionnement de goudron de houille,
il fut ensuite décelé dans la plupart des goudrons. Les goudrons de
houille-le en sont actuellement la principale source industrielle. On peut
dire que le chrysène est un composé quasi permanent forme au cours de la
pyrogénation de nombreuses substances organiques, voisinant dans ce cas avec
d'autres composés polycycliques aromatiques et hétéroatomiques. A ce titre,
et grâce aux perfectionnements des méthodes de séparation et
d'identification, il a été décelé, ainsi que ses dérivés mono- ou diméthylés,
dans les goudrons ou la fumée de tabac et dans l'atmosphère des grandes
villes.
Présent dans le règne
minéral, en particulier dans certaines huiles minérales et dans le
"stupp-fett", produit résiduel de l'extraction du mercure, il est
également signalé dans le règne animal, mais ayant vrai-semblablement dans ce
cas, une origine exogène. C'est ainsi qu' il a été identifié, en particulier,
dans les pédoncules de certains coquillages marins.
Au fur et à mesure que se
multiplieront les résultats fournis par l'étude chimique de sa molécule et
que seront synthétisés de nouveaux dérivés, l'importance du chrysène ira en
s'accroissant, débordant bientôt le cadre purement chimique, pour pénétrer
dans les domaines de la biochimie et de la biologie.
La similitude du noyau du
chrysène avec le squelette fondamental du cholestérol, sa présence dans les
produits de dégradation de ce même cholestérol, avaient aidé, après de
nombreuses recherches, à établir la structure de ce composé.
La parenté de structure
chimique de certains dérivés du chrysène avec celle des hormones naturelles
du groupe des stéroïdes et en particulier des hormones oestrogènes était
d'autant plus intéressante, eu égard à l'activité cancérogène des dérivés du
chrysène. Il est inactif ou très peu actif par lui-même quand il est pur,
mais en revanche, certains de ses dérivés, plus particulièrement ses homologues
mono- ou diméthylés se sont révélés doués d'un assez fort pouvoir
cancérogène. L'étude de cette activité devenait d'autant plus intéressante en
raison de la multiplicité même des sources où sa présence avait été décelée.
D'un point de vue un peu
différent, LACASSAGNE et ses collaborateurs avaient montré, il y a quelques
années, que des hydrocarbures polycycliques très peu cancérogènes, tels que
le chrysène, peuvent se comporter comme antagonistes d'autres hydrocarbures
fortement cancérogènes. Des recherches avaient été entreprises par LACASSAGNE
et ses collaborateurs dans le but de voir si, par des modifications chimiques
adéquates effectuées sur la molécule du chrysène, on ne pouvait pas faire
disparaître complètement l'activité oncogène et augmenter par contre le
pouvoir antagoniste vis à vis de la cancérisation. Des essais biologiques
avaient été réalisés dans ce but avec l'amino-6 chrysène. Les premiers
résultats étaient encourageants, BUU-HOÏ en particulier avait étudié plus
amplement la chimie de l'amino-6 chrysène.
Adoptant ce point de vue,
et dans le cadre des travaux généraux sur les hydrocarbures polycycliques
poursuivis à l'Institut du Radium, nous nous sommes proposé de préparer de
nouveaux composés aminés du chrysène et de réaliser également la synthèse de
carbures aromatiques hexacycliques dont l'étude biologique pouvait se révéler
intéressante.
De telles synthèses
faisaient appel le plus généralement à des réactions de substitution. Désirant
parvenir à élucider la structure des nouveaux composés ainsi obtenus, nous
avons été conduit à étudier plus spécialement quelques uns des problèmes
relatifs aux substitutions effectuées en série chrysénique.
Les premiers travaux
concernant les réactions de substitution effectuées sur le noyau du chrysène
remontent à la fin du siècle dernier, mais restaient limités à des domaines
restreints tels que la nitration ou l'oxydation, tandis que parallèlement, se
poursuivaient les recherches destinées à élucider la structure du chrysène
lui-même.
A part quelques
travaux isolés, en particulier ceux de LIEBERMANN et ZSUFFA ou de WEITZENBOCK
et LIEB concernant des acides chrysène-carboxyliques, l'étude des dérivés
substitués du chrysène s'est maintenue dans un demi sommeil jusque vers les
années 1933-1955.
A cette époque, le désir de renouvellement dans
l’arsenal des colorants de cuve, suscite des recherches dans de nombreuses
directions dont va bénéficier eh particulier le chrysène, comme l'attestent
les brevets concernant des dérivés substitués du chrysène, pris par
d'importantes firmes allemandes.
Ce nouvel élan sera suivi
d'études plus approfondies concernant la réaction de FRIEDEL-CRAFTS en particulier,
comme en témoignent les travaux de FUNKE et de ses collaborateurs. Cependant,
les difficultés sont grandes, la présence d'isomères nécessite des
séparations délicates et bien souvent la structure de certains d'entre eux
n'est établie que peu à peu, grâce aux apports et aux recoupements rendus
possibles par les progrès de la chimie dans les domaines voisins.
Ainsi s'expliquent les
mises au point et les contributions apportées successivement par divers
chercheurs : pour n'en citer que quelques-uns, nous rappellerons les travaux
de NEWMAN et CATHCART en 1940, concernant les dérivés nitrés et aminés du
chrysène, ceux de BERGMANN et ESCHINAZI en 1945, puis de CARRUTHERS en 1955,
traitant de l'acétylation du chrysène, les études de CLAR et KELLY en 1957 se
rapportant aux cétones o.méthylées dérivées du chrysène. Tous ces travaux
étaient d'ailleurs plus spécialement consacrés à l'étude des produits de
monosubstitution.
Au cours de la conduite
générale de notre travail qui était orienté par le désir que nous avions de
parvenir à l'obtention de composés biologiquement intéressants, nous nous
sommes efforcé , en premier lieu, de mettre au point certaines techniques de
préparation de composés déjà connus qui étaient pour nous des matières premières
essentielles.
Nous nous sommes
attaché ensuite, dans le cadre de
notre étude des problèmes de substitution relatifs à la chimie du chrysène, à
établir les preuves de constitution de quelques composés décrits dans la
littérature, mais dont les structures n'avaient pas encore été précisées.
L'établissement de ces preuves nous amena à préparer un certain nombre
d'autres dérivés, le plus généralement disubstitués, dont nous avons
également cherché à déterminer les structures.
Nous avons tenté enfin,
le plus fréquemment possible, de faire un parallèle entre nos résultats et
les données des recherches antérieures. Nous avons également, dans certains
cas, comparé nos résultats avec ceux que pouvaient laisser pré-voir les
données récentes de la chimie théorique.
Voici maintenant, très
brièvement esquissé, le plan général du présent travail ; il comprend six
parties :
PREMIERE PARTIE : Etude
des matières premières :
- Chrysène.
- Acétylation du chrysène.
- Benzoylation du chrysène.
DEUXIEME PARTIE : Acylation selon FRIEDEL et CRAFTS de
chrysènes substitués en -6.
TROISIEME PARTIE : Monocétones o.méthylées dérivées du chrysène Réaction d'Elbs.
QUATRIEME PARTIE : Dicétones o.méthylées dérivées du chrysène.
CINQUIEME PARTIE : Dérivés nitrés et aminés de l'éthyl-6 chrysène.
SIXIEME PARTIE : Composés divers dérivés du 5H-benzo [b]
carbazole.
CONCLUSION
Au cours du présent
travail, dont le but était d'étudier quelques uns des problèmes de
substitution relatifs à la chimie du chrysène, nous avons tout d'abord
précisé certaines méthodes de purification du chrysène commercial, indiquant
en particulier une technique permettant d'assurer l'élimination du 5H - benzo
[b] carbazole.
En ce qui concerne les
problèmes de substitution, nous pouvons essayer de déduire, des résultats
obtenus, quelques indications de portée générale qui résument et représentent
l'essentiel de notre contribution :
1.-Réactions de monosubstitution.
Conformément aux prévisions de la chimie théorique, lors des acylations selon FRIEDEL et
CRAFTS, effectuées avec des chlorures d'acides aliphatiques ou aromatiques,
il apparaît que le sommet préférentiel de substitution est le sommet 6 du
noyau du chrysène. Mais à côté des composés monoacylés substitués en -6 et
formés d'une manière prépondérante, nous avons décelé, en général, la
présence de deux autres isomères, obtenus avec de très faibles rendements et
dont, pour cette raison, les positions de substitution n'ont pu être
déterminées.
Dans le cas de
l'acétylation, la proportion relative de ces isomères peut être plus grande
et semble varier suivant les conditions expérimentales. Il est possible,
comme nous le montrons, et en opérant dans certaines conditions, de n'obtenir
que l'acétyl-6 chrysène et cela avec un bon rende-ment.
Les cétones obtenues sont
aisément réductibles selon la méthode de WOLFF - KISHNER.
2.- Réactions de substitut ion effectuées sur
des chrysènes substitués en -6.
Dans le cas d'acylations
d'alkyl-6 ou d'aryl-6 chrysènes, effectuées selon FRIEDEL et CRAFTS, avec des
chlorures d'acides aliphatiques ou aromatiques, nous avons montré que le
deuxième substituant se fixe en position 12 du noyau du chrysène.
Il en est de même lors de
la nitration effectuée sur un alkyl-6 chrysène. Le dérivé nitré obtenu peut
se réduire par 1'hydrosulfite de sodium en milieu alcoolique. Nous avons
synthétisé ainsi l'éthyl-6 amino-12 chrysène en raison de l'intérêt
biologique que pouvait présenter ce composé, par analogie avec les propriétés
antileucémiques que possèdent certains dérivés aminés du chrysène. En ce qui
concerne 1'expérimentation biologique de ce composé, nous ne possédons que des
résultats encore incomplets qui semblent cependant être assez prometteurs.
3.- Réactions de disubstitution.
Les diacylations, effectuées
selon FRIEDEL et CRAFTS, avec des chlorures d'acides aromatiques, conduisent généralement
à l'obtention de trois isomères diacylés, conformément à ce qui avait été
déjà signalé pour la dibenzoylation du chrysène.
4.- Réactions d'ELBS effectuées sur des
cétones o.méthylées dérivées du chrysène.
Les monocétones
o.méthylées substituées en position 6 conduisent, après pyrolyse selon ELBS,
à l'obtention d'un mélange contenant une forte proportion de composé
hexacyclique oxygéné, à côté d'une très faible proportion de l'hydrocarbure
hexacyclique correspondant.
5.- Dérivés du 5H - benzo [b] carbazole.
Le 5H - benzo [b]
carbazole, dont nous avons vérifié la présence dans le chrysène technique,
est susceptible de réagir au cours des acylations selon FRIEDEL et CRAFTS,
avec des chlorures d'acides aliphatiques ou aromatiques en donnant des
dicétones. Ces diacylations semblent se faire, sur un mélange de chrysène et
de 5H - benzo [b] carbazole, plus facilement que lorsqu'elles sont effectuées
sur le benzocarbazole pur.