Doctorat d'état es sciences
physiques présenté à Université Paris VI
pour obtenir le grade de
Docteur-es Sciences
par
Jean-Christophe Doré
Contribution à l’étude de la
nitration par le peroyde d’azote de composés éthylèniques à double liaison
activée
soutenue le 22 avril 1974
devant la commission
d'examen :
Rigaudy, J., président
Basselier, J. J., Poisson,
J., Rumpf, P., et Viel, C., examinateurs
2ème thèse
INTRODUCTION
Le peroxyde d’azote (N2O4) est
un réactif utilisé pour la synthèse en chimie organique depuis la fin du 19eme
siècle. Il possède, à la fois, des propriétés oxydantes et nitrantes dont le
mécanisme d'action, à l’opposé de celui de l’acide nitrique, ne se caractérise
pas par une substitution électrophile au niveau d’une liaison nultiple
carbone-carbone, mais par son addition sur celle-ci.
SEMENOV a montré, dès 1864, que
les oxydes d'azote s’additionnent aux composés non saturés. Mais, il a fallu
attendre les travaux de GABRIEL, de GUTHRIE et de DEM'YANOV pour que les
conditions de l'addition de peroxyde d’azote sur des dérivés éthyléniques
soient précisées, ainsi que la nature des produits obtenus.
DEM’YANOV a ainsi préparé le
dinitro-1,2 éthane à partir de l’éthylène.
Toutefois, ce sont les
recherches de WIELAND qui ont permis de dégager des résultats systématiques
concernant cette réaction que cet auteur généralise, par ailleurs, aux
composés acétyléniques.
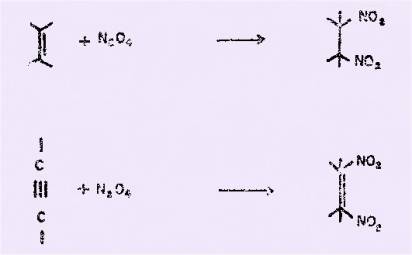
Malheureusement, le bilan
réactionnel n’est pas toujours aussi simple et de nombreuses études ont
montré qu'en dehors de ces molécules a, b dinitrées, un
certain nombre d'autres composés peuvent se former ou même prédominer
selon les conditions opératoires. On relève, ainsi, dans la littérature
de fréquentes allusions à le. présence d'esters nitreux et d'esters
nitriques dont la présence a été expliquée par le schéma réactionne1 suivant.
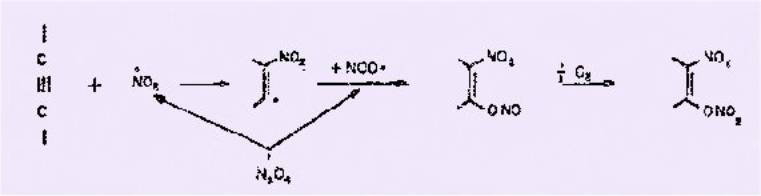
L’intérêt de la nitration par le
peroxyde d'azote se trouve donc limité par la présence de composés nitrés en mélange et de
plus, par la réactivité parfois capricieuse de cet agent nitrant.
En effet, si la réaction est
énergique avec les éthyléniques stricts au point qu'elle nécessite l'utilisation de très
basses températures, à l'opposé, elle ne s'effectue pas avec les noyaux
aromatiques.
D'autre part, hormis l'addition
aux acétyléniques qui conduit à des éthyléniques a,
b
dinitrés, la réaction avec cas éthyléniques ne permettait l'obtention que
de dérivés du dinitro-1,2 éthane qui sont des intermédiaires de synthèse peu
intéressants. En effet, la réaction d'élimination de HNO2 permettant le retour
à un composé mono-nitroéthylénique est en général très laborieuse.
Ainsi, à partir du stilbène, 1'a-nitrostilbène a bien été obtenu, mais avec des
rendements médiocres
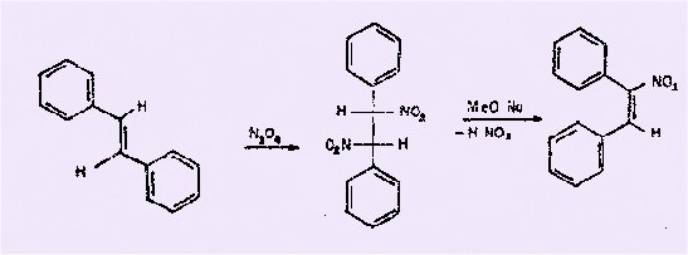
Ce résultat s'explique par le
fait que l'arrachement d'une molécule d'acide nitreux à la molécule de
diphényl dinitroéthane exige un milieu fortement basique. Or, l'emploi de
méthylate de sodium conduit à une réaction concurrente qui tend à dégrader 1'a-nitrostilbène
formé.
Signalons enfin que la réaction
du peroxyde d'azote avec les diènes conjugués se résume en une addition 1,4
de ce réactif avec formation de dinitro-1,4 bufcène-2 dans le cas du butadiène.
L'étude de l'action du peroxyde
d'azote sur des doubles liaisons, préalablement substituées par un
groupement à caractère électrodonneur ou électroattracteur, a fait l'objet de
peu de recherches. En série éthylénique normale par exemple, les résultats sont
complexes et des échecs ont même été rencontrés lors de tentatives de
nitration. Ainsi, VASIL'EV rapporte que l'action du peroxyde d'azote sur les
éthers vinyliques ne conduit qu'à des polymères non analysables et fort
instables, et ce même auteur, étudiant l'action de ce réactif sur les cétones
aliphatiques non saturées,observe à partir de méthyl-vinyl cétone la
formation d'un composé auquel il attribue la structure 1, composé très instable
qui s'hydrolyse rapidement pour conduire au céto-alcool nitré correspondant 2.
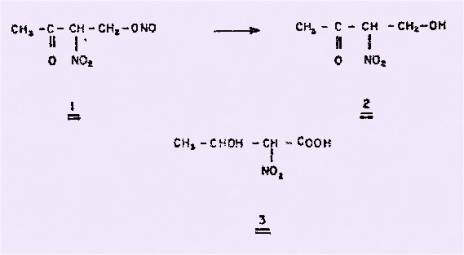
De même à partir d'acide
crotonique, VASIL’EV obtient un composé instable non caractérisé qui s'hydrolyse en acide
hydroxy-2 nitro-3 éthane carboxylique-1, 3. Par contre, un travail de SHECHTER et
CONRAD, concernant la nitration de l'acrylate de méthyle par le peroxyde
d'azote, a permis à ces auteurs de mettre en évidence la présence d'un
composé nitro-éthylénique, le B-nitro acrylate de méthyle, dans un mélange de
composés polymérisés et de nitro-2 hydroxy-î propionate de méthyle.
De la même façon, en série
styrénique ou stilbénique a ou b substituée par
des groupements électrodonneurs ou électroattracteurs, la littérature
indique des résultats souvent négatifs et quelquefois contradictoires.
Ainsi, l'action du peroxyde
d'azote sur l'acide cinnamique a conduit au b-nitrostyrène
et non à l'acide a-nitrocinnamique. Par contre, le même réactif, réagissant avec
les esters éthylique ou méfchylique de cet acide,donne essentiellement le composé
de structure 4. Mais PIET, effectuant la même réaction, attribue au produit liquide
qu'il obtient la structure a-nitrocinnamate de méthyle 5_ dont le
mélange des deux isomères fausse les constantes physiques
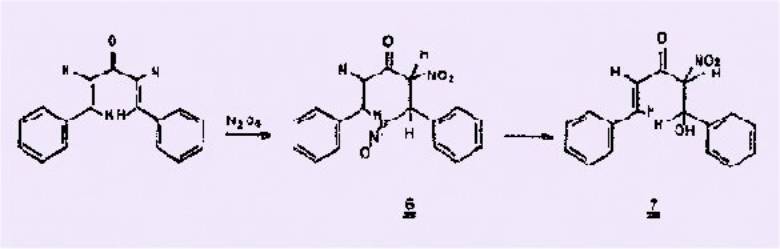
Les a-nitrocinnamates
de méthyles préparés par synthèse univoque se présentent dans leurs isomères
cis ou trans purs nous forme solide.
Cependant, un travail récent de
NOVIKOV et collaborateurs semble être plus riche d’enseignements. En effet, cet
auteur, en nitrant le b-nitrostyrène par le peroxyde d'azote
dans divers solvants, obtient des résultats très différents dans l'éther et le
tétrachlorure de carbone : l'opération fournit dans l'éther le composé de structure
8, et dans le tétrachlorure de carbone, le b, b-dinitrostyrène
9, avec un rendement de 39%.
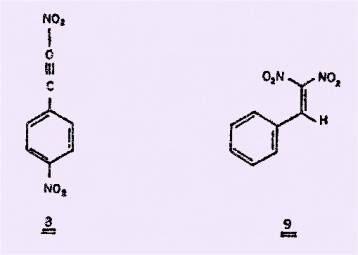
L'incohérence des différents
résultats précités s'explique de façon satisfaisante si l'on considère qu'aucun
des auteurs n'avait attaché une importance primordiale aux conditions opératoires,
l'habitude étant d'utiliser divers solvants, le plus souvent l'éther, et de
procéder à la nitration par un barbotage plus ou moins prolongé de N204 sans
se préoccuper des conditions d'anhydricité du milieu.
Les résultats obtenus par les
auteurs soviétiques dans le tétrachlorure de carbone s'expliquent très bien par un
mécanisme simple.
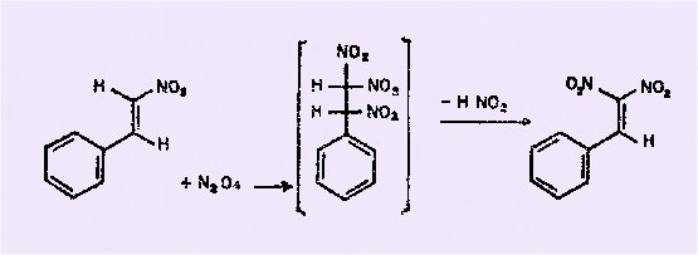
Le peroxyde d'azote s'additionne
en premier lieu à la double liaison êthylénique selon le mécanisme initialement
proposé par WIELAND, mais le caractère fortement acide du proton géminé avec deux
groupes N02 permet une décomposition spontanée du produit intermédiaire avec
départ d'acide nitreux, régénération d'une double liaison et formation d'un
composé éthylénique gem-disubstitué par deux groupements nitrés.
PIET ayant préparé dans de
bonnes conditions l'a-nitrocinnamonitrile par action directe
du peroxyde d'azote sur le cinnamonitrile en solution dans le tétrachlorure de carbone, nous
avons cherché à généraliser ce type de nitration en vue de l'obtention de dérives
styrêniques substitués en b par un groupe N02 géminé avec un second
groupement êlectro-attracteur.
CONCLUSI0N
Pour clore l’expose de cette
brève étude dent la systématisation se poursuit actuellement dans notre
Laboratoire, nous pensons pouvoir résumer comme suit les résultats acquis.
Tout d'abord, si nous
n'apportons aucune preuve décisive concernant le mécanisme d'action du
peroxyde d'azote, nous pensons que notre étude a précisé les conditions expérimentales
d'emploi de ce réactif.
Par ailleurs, les composés
nitrés que nous avons obtenus s'avèrent être plus de simples curiosités de laboratoire.
En effet, un certain nombre d'entre eux sont actuellement à la base de
synthèses plus complexes, dans le cadre de la réalisation de molécules analogues à
celles de produits naturels. Ainsi, un travail est en cours dans
notre laboratoire, pour tenter d'obtenir à partir d'a-nitrochalcones,
des benzyl-3 isoquinolêines 47 , analogues structuraux de la papavérine dont la
préparation par les méthodes usuelles est particulièrement difficile. D'autre part, les
a-cyano b-nitrostilbènes sont des matières
premières intéressantes pour accéder à des composés comparables à la tylocrêbine et à
la tylophorine 48, alcaloïdes antitumoraux, par des synthèses entreprises également dans
notre Laboratoire.
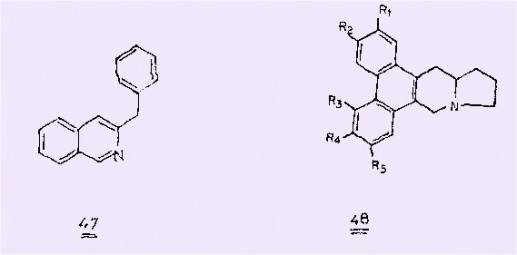
Enfin sur un plan plus général,
le peroxyde d'azote paraît constituer un réactif précis pour l'obtention de composés
éthylèniques tétrasubstitués très divers. Mots clefs : éthylénique /
résultat / réaction / réactif / méthyle / carbone / action / synthèse / nitration /
tétrachlorure / structure / molécule / mécanisme / liaison / laboratoire / éther / nitrostilbène
/ éthane / ester / yanov / wieland / vasil / styrénique / rendement / recherche / piet / nitrostyrène / nitrocinnamate
isomère / hydrolyse / électrodonneur / électroattracteur / acrylate / acétylénique / azote /
peroxyde / vinyliques / vinyl / tylophorine / tylocrébine / substitution /
dore / rigaudy