Thèse
de sciences présentée à Faculté des sciences de l'université de Paris
pour
obtenir le grade de Docteur de l'Université
par
André
Le Berre
Hydrocarbures
indénofluoréniques orthoquinoïdes. Recherches en rapport avec leur autoxydation
soutenue
le 8 janvier 1957
devant
la commission d'examen :
Quelet,
R., président
Willemart,
Julia, M., examinateurs
INTRODUCTION
La formation de peroxydes cycliques par fixation d'oxygène
moléculaire sur les diènes conjugués est très généralement considérée comme une
réaction spécifiquement photochimique, à la suite des travaux de Ch. Dufraisse
et de ses collaborateurs, notamment sur la photooxydation des acènes. L'on
suppose habituellement que le rôle de la lumière dans cette réaction pourrait
être de provoquer le découplement des liaisons du diène en un état
diradicalique réagissant ensuite avec oxygène :
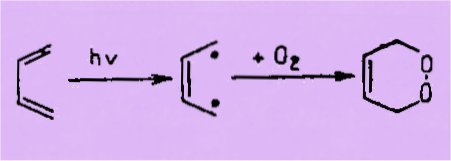
S'il eu est bien ainsi,
l'obtention d'un peroxyde cyclique par photooxydation d'un diène conjugué peut
être assujettie à deux propriétés de ce diène : la faculté qu'ont les doubles
liaisons d'être activées par la lumière en un état diradicalique et leur place
dans la molécule qui doit leur permettre de donner avec oxygène un cycle stable
à cinq ou six chaînons. Il devrait être possible, par suite, d'obtenir des
peroxydes cycliques, par autoxydation non photochimique, à partir de composés
diéniques particuliers, de structure convenable, pour lesquels l'on pourrait
concevoir l'existence, avant toute photoactivatiun, d'un état diradicalique
fondamental :
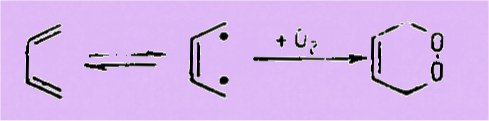
Des hydrocarbures
susceptibles d'exister, tout au moins partiellement, sons une forme
diradicalique sont principalement les quinodiméthanes et les composés
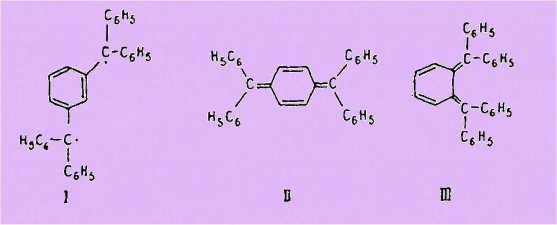
apparentés dérivés du diphényle, du terphényle etc... Toutefois parmi-ces
hydrocarbures seuls les dérivés méta, tels que (I), possèdent un net
paramagnétisme et sont par suite des diradicaux vrais. Les dérivés para, tels
que (II), qui ne sont pas ou seule-ment très peu paramagnétiques sont cependant
considérés comme des biradicaloïdes, c'est-à-dire comme des composés capables
d'exister partiellement sous forme diradicalique dans une proportion variable
suivant la température, du fait de la faible valeur de l'énergie de transition
nécessaire au passage de l'état fondamental paraqui-noïde à l'état activé
diradicalique. Quant aux dérivés ortho, tels que (III), qui seuls sont, de par
leur structure de diènes conjugués, aptes à former des peroxydes cycliques, ils
ne sont pas connus, probablement par suite d'une trop grande instabilité, ainsi
qu'en témoignent par exemple les résultats des essais de préparation du
tétraphényl ortho-xylylène (III).
On a pensé que certains composés dérivant des
orthoquinodiméthanes pourraient être préparés et seraient capables de présenter
ce caractère biradicaloïde, tel qu'il est défini plus haut, et par suite
seraient aptes à se transformer facilement en une forme diyle pouvant fixer
oxygène « en pont » pour donner un peroxyde cyclique. Le choix s'est
porté sur les hydrocarbures orthoquinoïdes indénofluoréniques (Vlla et VIIb)
qui peuvent être considérés comme dérivant l'un du diphénylquinodiméthane (VIa)
et l'autre du tétraphénylquinodiméthane (Vlb) par liaisons ortho-ortho de deux
phényles sur le phénylène. Ces cyclisations supplémentaires laissent la
possibilité de prévoir encore des formes diradicaliques, et devraient notamment
avoir pour effet d'augmenter la stabilité par accroissement de la résonance.
D'autre part, on peut faire ressortir les analogies structurales
existant entre les indénofluorènes (VII) et les anthracènes (V), ces deux types
d'hydrocarbures pouvant être eux-mêmes considérés encore comme dérivant
respectivement du diphényl- et du triphénylméthyle (IVa et IVb). Rappelons, en
effet, que la structure du mésodiphénylanthracène (Vb) a déjà été envisagée comme
provenant de la mise en commun de deux phényles de deux molécules de
triphénylméthyle (IVb), conception qui avait permis de prévoir la
photooxydabilité de cet anthracène mésodiphénylé ; il va de soi que la formule
de l'anthracène lui-même (Va) peut être envisagée d'une manière analogue comme
dérivant de celle du diphénylméthyle (IVa). Enfin, si l'on considère que la
mise en commun de deux molécules de diphényl- ou de triphényl-méthyle est
effectuée par fusion d'un seul phényle, on aboutit respectivement au diphényl-
et au tétraphényl-orthoquinodimélhane (Via et VI6), desquels on peut passer à
l'indénofluorène (VIIa) et au diphényl-indénofluorène (VII6) par liaisons
ortho-ortho' de deux phényles sur le phénylène, comme on l'a dit ci-dessus.
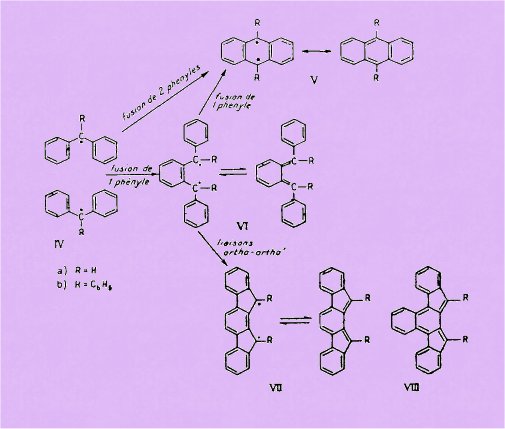
Les recherches ont donc
été orientées vers la préparation de l'indéno [2,1-a] fluorène (VIIa) et de son
dérivé diphénylé en 11.12 (VII6), et elles ont été étendues au benzologue
correspondant : le benzo [c] indéno [2,1-0] fluorène (VIIIa), et à son dérivé
diphénylé en 13. 14 (VIII6), ces deux derniers corps étant susceptibles de
présenter un état diradicalique plus prononcé par suite de l'annellation
supplémentaire pouvant avoir une influence marquée sur la résonance de la
molécule.
Au cours de ces travaux nous avons été amenés à préparer un
certain nombre de dérivés dihydroindéno- et benzoindénofluoréniques, dont nous
décrirons les propriétés les plus marquantes. Ces composés, qui peuvent être
considérés naturellement comme des bisfluorènes, se rapprochent par leur stabilité
et par leurs propriétés des dérivés fluoréniques les plus simples.
La stabilité constatée de ces dérivés dihydroindénofluoréniques
rend compte de la difficulté que l'on a rencontrée pour obtenir les corps à
structure orthoquinoïde correspondants. Ainsi, l'indéno [2,1-a] fluorène (VIIa)
et son benzologue (Villa) n'ont pu être isolés, probable-ment en raison de leur
trop grande réactivité. Un effet stabilisant prévisible est obtenu lorsque les
hydrogènes des cycles pentagonaux de ces hydrocarbures sont remplacés par des
phényles : le diphényl-11.12 indéno [2,1-0] fluorène (VI16), en particulier,
s'est révélé assez stable pour pouvoir être isolé à l'état cristallisé, mais
son benzologue (VIII6), par contre, l'est beaucoup moins et il n'a pu être
caractérisé qu'en solution, aussitôt après sa formation. Quoique le diphényl-11.12 indéno [2,1-a] fluorène (VIIb) ne
soit pas un biradical vrai, par suite de l'absence de paramagnétisme, il peut
être considéré comme un biradicaloïde, car il est autoxydable en solution
(benzène, par exemple) à l'obscurité complète, et d'autant plus rapidement que
la température est plus élevée. Cette autoxydation qui s'effectue avec
absorption d'une seule molécule oxygène ne conduit toutefois qu'à un produit
non cristallisé, formé probablement par un mélange complexe de peroxydes
polymérises, au lieu du peroxyde cyclique (IX) attendu. Quelques réactions
permettent de supposer cependant qu'il y a d'abord formation de ce peroxyde
cyclique (IX) qui serait très instable. C'est ainsi que l'autoxydation du
diphénylindénofluorène (VIIb), trop rapide pour être inhibée par les
antioxygènes en milieu neutre, conduit, avec certains de ces corps, qui
réagissent comme donneurs d'hydrogène, au diol correspondant (X) dont la
formation s'interprète facilement par transformation du peroxyde cyclique (IX)
formé auparavant. D'autre part, si l'autoxydation est effectuée en milieu acide
faible (acide acétique), elle fournit le benzoyl-1 ortho-hydroxyphényl 2
phényl-9 hydroxy-9 fluorène (XI) dont la structure a été déterminée
spécialement et qui peut également être considéré comme un produit de
transformation du peroxyde (IX).
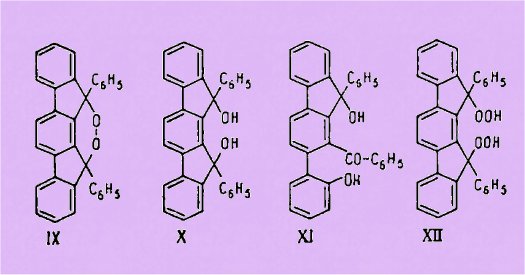
En vue de confirmer l'instabilité de ce peroxyde (IX), ou tout au
moins sa transformation en milieu acide, l'on a appliqué une réaction
préconisée par Criegee pour obtenir certains peroxydes cycliques (action du
tétracétate de plomb sur des bishydroperoxydes appropriés) au cas du
bishydroperoxyde (XII) préparé par le procédé classique (perhydrol sur le
dérivé dibromé correspondant). L'on a, en fait, obtenu la même hydrocétone (XI)
que par autoxydation en milieu acide de l'hydrocarbure (VIIIb), ce qui fournit
un argument supplémentaire en faveur de la formation transitoire du peroxyde
cyclique (IX) dans celle autoxydation.
Quant au diphényl-13. 14 benzo [c] indéno [2,1-a] fluorène
(VIIIb), quoique extrêmement instable, il donne néanmoins un certain nombre de
réactions montrant qu'il se comporte vis-à-vis de l'oxygène d'une manière
analogue à son benzologue inférieur (VIIb).
En définitive, le but initial de ce travail qui était la
recherche de composés diéniques particuliers possédant un caractère
biradicaloïde, puis l'obtention par autoxydation non photochimique des
peroxydes cycliques correspondants, n'a pu être que partiellement atteint. En
effet, des hydrocarbures indénofluoréniques orthoquinoïdes que nous avions
choisi de préparer dans ce dessein seuls ont pu être obtenus les dérivés
diphénylés (VII6 et VIII6), dont l'un à l'état cristallisé. Les propriétés de
ces hydrocarbures d'un type nouveau permettent de les considérer effectivement
comme des biradicaloïdes; en particulier ils se sont révélés autoxydables même
en l'absence de lumière. Toutefois il n'a pas été possible d'isoler les
peroxydes cycliques tels que (IX) attendus. Nous avons cependant obtenu un
certain nombre de résultats d'après lesquels on peut considérer comme très
vraisemblable la formation de ces peroxydes cycliques lors de l'autoxydation
des com-posés (VI.I6 et VIII6).
L'ensemble de ce travail a été divisé en deux chapitres :
Chapitre premier. — Indénofluorènes et benzolndéoofluorènes.
Chapitre II. — Peroxydes indénofluoréniques et
benzoindéno-fluoréniques.
MOTS CLEFS :
hydrocarbure / diradicalique / autoxydation / fluorène / diphényl / oxygène / formation /
composé / structure / réaction / phényle / molécule / diène / biradicaloïde / propriété /
liaisons / indénofluorène / benzologue / photochimique / orthoquinoïde / lumière /
indénofluoréniques / anthracène / triphénylméthyle / tétraphényl / résultat / résonance /
recherche / préparation / photooxydation / phénylène / paramagnétisme / orthoquinodiméthane /
hydrogène / fluorénique / diénique / analogue / peroxyde / cyclique / dérivé / quelet