Thèse
présentée à la Faculté des sciences de l'Université de Paris
pour obtenir le grade de Docteur es Sciences Physiques
par
Georges Laude
Contribution à l'étude de l'oxydation ammoniacale des principes carbonés. Synthèses de
l'acide cyanique
soutenue en octobre 1929
devant la commission d'examen :
Bertrand, G., président
Mouton, H., Fosse, R., examinateurs
INTRODUCTION
Les dérivés de
l'imide de l'acide carbonique ou carbimide 0 = C = NH sont connus depuis
longtemps sous le nom de cyanates.
A un corps de
composition CONH on peut attribuer les trois formules de constitution
suivantes :
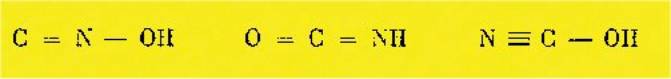
La
première formule C = N — OH est celle de l'acide fulminique dont les sels,
les fulminates ont des propriétés très différentes des cyanates.
Cet
acide subit l'hydrolyse à chaud suivant la réaction :
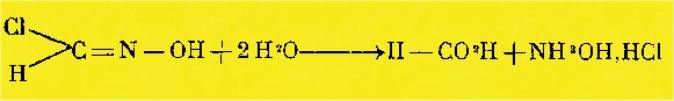
On
peut donc considérer l'acide fulminique comme l'oxime de l'oxyde de carbone.
La
deuxième formule 0 = C = NH, imide de l'acide carbonique, connue depuis
longtemps, est désignée sou-vent par abréviation sous le nom d'acide
cyanique.
Nous
devrions toujours l'appeler acide isocyanique, le nom d'acide cyanique devant
être réservé à la troisième formule

qui seule renferme le radical cyanogène
L'acide
cyanique vrai
![]()
n'est pas connu à l'état de
liberté et il n'est pas sûr que ses éthers aient été préparés par Cloez.
On
sait que les cyanates se forment facilement par oxydation des cyanures, ou
par l'action des bases sur le chlorure de cyanogène. Mais leur obtention par
oxydation des composés organiques, autres que les cyanures était considérée
comme irréalisable.
Toutes
les tentatives faites pour obtenir l'acide cyanique dans ces conditions
n'avaient conduit qu'à des résultats négatifs.
Selon
Gorup Besanez, cité par Dreschel, il n'existe pas de preuves de la formation
de l'acide cyanique aux dépens de substances organiques par oxydation.
Halsey
voulant obtenir l'acide cyanique par oxydation du glycocolle, de l'acide
oxamique et de la formiamide, avait conclu à sa non formation.
De
même Eppinger n'avait pu caractériser l'acide cyanique en oxydant le
glycocolle.
Il
était ainsi admis dans la littérature chimique qu'on ne pouvait faire d'acide
cyanique par oxydation ammoniacale des composés organiques.
M.
R. Fosse en cherchant l'origine de l'urée formée par oxydation des principes
carbonés, a démontré que les protides, les acides aminés, la glycérine, les
glucides (glucose, lévulose, saccharose), l'aldéhyde formique, engendrent
l'acide cyanique par oxydation en présence d'ammoniaque.
L'acide
cyanique a ensuite été obtenu par M. R. Fosse et nous-même en oxydant en
présence d'ammoniaque plusieurs représentants des fonctions oxygénées et des
fonctions azotées.
Par
une étude méthodique et systématique de l'oxydation ammoniacale des principes
carbonés, nous nous proposons de chercher si cette formation de l'acide
cyanique est une réaction générale de la chimie organique.
Nous
voulons aussi comparer tous les résultats obtenus dans le but-de chercher à
mettre en évidence un processus de formation de la carbimide.
Nous
étudierons d'abord, séparément et successivement les facteurs intervenant
dans la transposition moléculaire du cyanate d'ammonium en urée en vue de
déterminer les conditions les meilleures pour une transformation intégrale de
l'acide cyanique en carbamide.
Nous
en ferons une application au dosage de l'acide cyanique dans un cyanate
commercial.
Tels
sont les buts que nous nous sommes proposés dans ce travail. Si nous avons
réussi dans notre entreprise. c'est grâce à la méthode d'analyse de l'urée de
notre Maître, M. le Professeur R. Fosse, et aux bons conseils qu'il nous a
toujours prodigués.
CONCLUSIONS
1.
— L'acide cyanique peut être dosé quantitativement par transformation de son
sel d'ammonium, en urée, sous l'influence des facteurs temps, température et
ammoniaque.
Lorsque
l'isomérisation du cyanate d'ammonium en urée est réalisée en milieu aqueux,
la transformation n'est jamais complète. Elle est intégrale lorsqu'on opère
en solution ammoniacale.
Il
suffit dans ces conditions de chauffer la solution de cyanate d'ammonium
pendant 10 à 15 minutes à la température de 90°.
Cette
méthode permet de déterminer rapidement et d'une façon rigoureuse le titre en
acide cyanique d'un cyanate commercial.
2.
— Les différents auteurs (Gorup, Besanez, Hofmeister, Halsey, Eppinger) qui
ont tenté la transformation des composés organiques en acide cyanique sous
l'influence de oxydation ammoniacale ont tous conclu à sa non-formation.
Il
était ainsi admis dans la littérature chimique qu'on ne pouvait faire d'acide
cyanique par oxydation des principes carbonés.
3.
— M. R. Fosse a montré que l'oxydation des matières protéiques, des acides
aminés, de la glycérine, des hydrates de carbone, du glucose, du lévulose, du
saccharose, de l'aldéhyde formique engendrait l'acide cyanique avec des
rendements souvent remarquables.
4.
— M. R. Fosse et nous-même avons montré qu'un grand nombre de fonctions
organiques permettait de réaliser la synthèse de l'acide cyanique.
5.
— Continuant l'étude méthodique de ces oxydations, nous avons établi que la
synthèse de la carbimide pouvait être réalisée à partir de principes carbonés
appartenant aux fonctions suivantes :
Carbone
pur.
Carbures
d'hydrogène.
Dérivés
halogènes.
Fonction
alcool.
Fonction
phénol.
Fonction
aldéhyde.
Fonction
acétone.
Fonction
acide.
Fonctions
acide alcool et acide phénol.
Fonction
aminé.
Fonction
amide.
Fonction
nitrile.
Fonction
carbylamine.
Composés
hétérocycliques.
Alcaloïdes.
66
synthèses de l'acide cyanique ont ainsi été réalisées.
Parmi
ces synthèses, il est intéressant de remarquer que nombre d'entre elles ont
été faites aux dépens de corps ne renfermant pas d'azote, l'azote ayant été
introduit dans la molécule par l'intermédiaire de l'ammoniaque.
Dans
la synthèse de l'acide cyanique aux dépens des corps azotés, la présence de
l'ammoniaque n'est pas indispensable, elle facilite cependant la réaction en
provoquant la décomposition du permanganate.
Nous
avons montré que la pyridine, corps cité dans la littérature chimique comme
l'un des plus résistants à l'action des oxydants, subit l'attaque du noyau et
se transforme partiellement en acide cyanique.
Le
carbone lui-même rigoureusement privé de toute trace de combinaisons
hydrogénées subit aussi la transformation en carbimide. L'identification de
celle-ci a été faite par tous les moyens dont nous disposons, transformation
en urée, réactions du cobalticyanate de potasse et de l'oxyurée effectuées sur
son sel d'argent.
6.
— Dans l'oxydation permanganique ammoniacale des composés organiques, l'acide
cyanique formé dans nos conditions expérimentales, ne dérive point de l'urée.
7.
— Pour comparer entre eux les rendements en acide cyanique produit par oxydation,
nous allons les représenter graphiquement.
L'examen
de ce tableau nous montre que :
A.
— Le corps qui présente l'aptitude la plus remarquable à engendrer l'acide
cyanique est L'ALDÉHYDE FORMIQUE.
Rendement
140 %. Aucun des nombreux corps étudiés n'atteint à beaucoup près ce chiffre.
Il constitue donc pour nous un excellent terme de comparaison.
B.
— Les corps étudiés qui permettent de passer facilement avec de hauts
rendements à l'acide cyanique sont :
a) Les phénols.
Les
phénols et par suite les acides-phénols sont des corps à partir desquels on
réalise facilement la synthèse de la carbimide.
b)
Les aminés et les corps se transformant facilement en aminés.
Les
aminés et les corps pouvant se transformer en aminés constituent des
principes carbonés permettant de passer aisément à l'acide cyanique. C'est
ainsi que les dérivés halogènes, malgré leur insolubilité qui rend malaisée
leur oxydation, permettent néanmoins de passer facilement à l'acide
isocyanique, par suite de leur transformation classique en aminés sous
l'influence de l'ammoniaque.
c)
Les corps pouvant se transformer directement ou indirectement en aldéhyde
formique.
L'éthylène
et l'acétylène, carbures les plus aptes parmi les autres à engendrer l'acide
cyanique ont été tous deux transformés par voie sèche en aldéhyde formique,
le premier, l'éthylène par Schützenberger en 1879, le second, l'acétylène par
Wolkow.
Parmi
les dérivés halogènes étudiés, c'est l'iodure de méthyle qui fournit les plus
hauts rendements en carbimide, et nous pouvons expliquer sa transformation en
aldéhyde formique par la relation
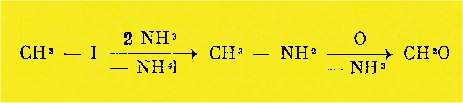
Parmi les alcools, c'est le
méthanol qui fournit 20,78% d'acide cyanique (exprimé en urée) parce que nous
avons la réaction classique

Les amines présentent, ainsi que nous l'avons dit, une
aptitude toute particulière à se transformer en acide cyanique.
Mais
notre graphique montre, que parmi ces corps, ce sont la méthylamine et la
diméthylamine qui donnent les résultats les plus intéressants, et ces
résultats s'expliquent encore par la formation d'aldéhyde formique
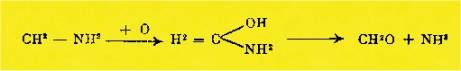
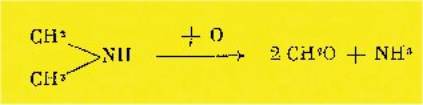
L'oxydation
de la méthylcarbylamine qui donne 48,21% d'acide cyanique, conduit aussi à
l'aldéhyde formique.
Nous
pouvons en effet admettre les réactions suivantes :

Cette
interprétation des résultats expérimentaux montre que l'aldéhyde formique ne
doit pas être considérée comme un simple terme de comparaison mais comme un
stade d'un processus d'oxydation des matières organiques.
Ces résultats s'accordent donc avec le
mécanisme de la formation artificielle de l'urée par oxydation des dérivés du
carbone, naturels ou artificiels, représenté par M. R. Fosse, par le schéma :
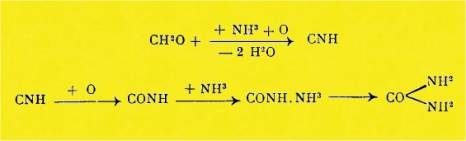
MOTS CLEF :
aldéhyde / cyanique / acide / urée / formique / organique / cyanate / résultat / fosse /
carbimide / ammoniaque / principe / phénol / dérivé / carbone / synthèse / réaction /
condition / ammonium / halogène / formule / alcool / synthèse / saccharose / méthode /
lévulose / isocyanique / imide / halsey / glycocolle / glycérine / fulminique / étude /
éthylène / eppinger / cyanures / cyanogène / carbure / besanez / azote / action / bertrand