Thèse
présentée à la Faculté des sciences de Lyon
pour
obtenir le grade de Docteur de l'Université
par ¶
Jean
Coillard
soutenue
le 17 décembre 1955
devant la
commission d'examen :
Colonge,
J., président
Pâris, R.,
Mentzer, C., examinateurs
INTRODUCTION
Les flavanonols qui se
trouvent dans les pigments naturels des fleurs et des fruits occupent une
place importante parmi les constituants végétaux. Comme nous le verrons par
la suite ils peuvent conduire aux autres dérivés de ce groupe. C'est pourquoi
il nous paraissait intéressant de faire leur synthèse.
Une voie d'accès possible
était ouverte par les recherches de ces dernières années.
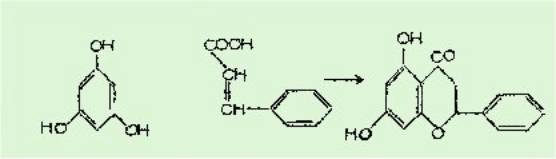
Pour la première fois en
1952 Mentzer a formulé que l'unité structurale phényl propane pouvait se
condenser dans les plantes avec un polyphénol, à propos de la biogénèse de la
pinocembrine, par action de l'acide cinnamique sur la phloroglucine.
L'année suivante en 1953
Moewus et Coll. ont apporté à l'hypothèse une première vérification
expérimentale. Travaillant sur un mutant de l'algue "Chlamydomonas
eugamétos » ces auteurs ont montré que l'acide dihydroxy-3-4 cinnamique
doit être considéré comme précurseur de la quercétine. Bien que
l'intervention de la phloroglucine n'ait pas pu être démontrée il faut admettre
qu'un corps voisin susceptible de se transformer en ce polyphénol, est
impliqué dans cette biosynthèse.
Mais d'autres unités
structurales en C6C3, différentes de l'acide cinnamique, pourraient se
condenser également avec les polyphénols. Mentzer et Pillon avaient montré
que la condensation de l’acide benzoyl acétique sous forme d'ester avec la
phloroglucine s'effectue aisément.
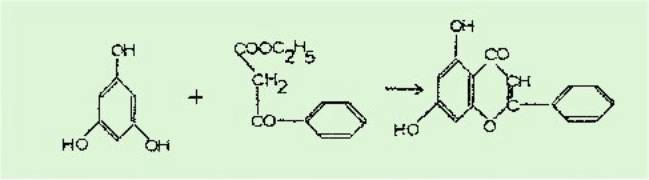
Aussi au début de l'année
1954 nous avons entrepris au laboratoire avec Pachéco la condensation de la
phloroglucine avec l'acide phényl pyruvique sous l'action du chlorure
d'aluminium ou du fluorure de bore afin d'obtenir un flavanonol selon la
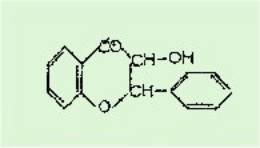
réaction hypothétique suivante :
L'acide phényl pyruvique
réagirait sous sa forme énolique et conduirait par élimination d'une molécule
d'eau, et transposition de l'hydrogène d'un groupe OH, au flavanonol appelé
Pinobanksine isolé par Erdtmann du Pinus Banksiana. Or les caractéristiques
du produit obtenu ne sont pas du tout celles de la Pinobanksine.
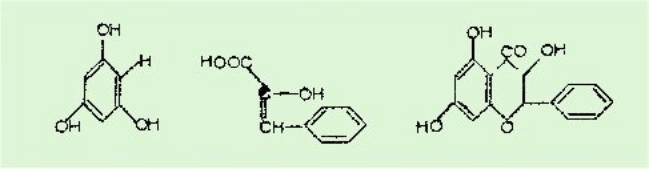
Nous obtenons en réalité
une benzal-3 coumaranone-2. La condensation ne se fait pas par
l'intermédiaire de la fonction acide mais par le OH phénolique. L'acide est
simplement lactonisé. La réaction est la suivante :
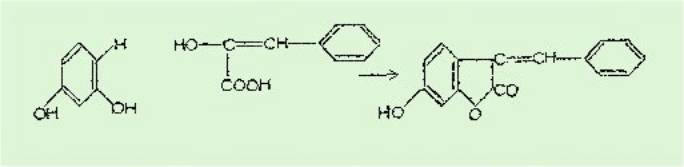
les essais dans ce cas ont
porté, non sur la phloroglucine mais sur la résorcine, qui permet d'obtenir
plus facilement des produits purs bien cristallisés.
Donc contrairement à
l'hypothèse de la condensation de l'acide phényï pyruvique avec un polyphénol
donnant un produit naturel, nous n'avons pu obtenir qu'un composé, non encore
isolé dans la nature jusqu'à ce jour, à savoir une benzal-3 coumaranone-2.
Cinq constituants de ce groupe seulement ont été décrits dans la littérature.
Nous nous sommes alors
attachés à préparer de cette façon un certain nombre de benzal-3 coumaranone-2,
afin de vérifier si cette réaction peut se généraliser. Des méthodes plus
classiques permettant d'accéder à ces mêmes composés, nous ont permis
d'établir d'une façon certaine, la structure de ces corps ainsi que de leurs
dérivés et de leurs produits de dégradation.
CONCLUSION
Partant de l'hypothèse que
la biogénèse des flavanonols naturels pouvait avoir lieu par combinaison d'un
phénol et d'un acide aryl pyruvique, nous avons condensé la résorcine avec
l'acide phényl pyruvique. La réaction que nous avons pu réaliser entre ces
deux composés à l'aide du chlorure d'aluminium comme catalyseur, nous a
conduit à un constituant d'une autre série de corps, "les benzal-3
coumaranones-2" dont 5 seulement étaient connues.
Pour démontrer que notre
corps répond bien à cette structure, l'analyse élémentaire et les dosages
effectués se révélaient insuffisants, car la position des substituants
restait indéterminée. Nous avons du entreprendre de nouveau la synthèse de ce
composé par d'autres méthodes plus classiques, et nous sommes ainsi parvenus
à prouver d'une façon certaine la structure de l'hydroxy-6 benzal-3
coumaranone-2.
Nous avons ensuite
généralisé notre technique de condensation aux polyphénols et à divers autres
acides aryl pyruviques, ce qui nous a permis de préparer un assez grand
nombre de benzal-3 coumaranones-2, entre autres celles que Gripenberg avait
synthétisées selon la méthode de Czaplicki.
Les benzal-3 coumaranones-2
se rattachent cependant aux flavanonols naturels. En effet deux de ces
derniers, l'ampélopsine et la fustine ont été transformés par transposition
benzilique en solution potassique, en benzal-3 coumaranones-2
correspondantes. Nous avons pu démontrer d'identité du produit ainsi
transposé de la fustine avec la (méthoxy-6 benzal)3 diméthoxy-3-4
coumaranone-2 préparée selon notre technique.
Le cycle lactone des
benzal-5 coumaranones-2 est plus ou moins facilement ouvert en solution
potassique, et méthylé au moyen du sulfate de méthylé. Les aryl cinnamates
ainsi obtenus par saponification, conduisent aux acides stilbène-carboniques
qui par action du cuivre et de la quinoléine perdent leur fonction acide.
Cette série nouvelle de stilbènes se distingue des stilbènes naturels par lu
présence d'un substituant en position 2.
Les acides stilbène-carboniques
peuvent être aussi obtenus directement sans l'intermédiaire des benzal-5
coumaranones-2 en condensant les polyphénols complètement méthylés avec les
acides aryl pyruviques selon la technique mise au point pour les benzal-5 coumaranones-2.
Cependant cette
réaction n'est pas générale puisque dans le cas de l'éther diméthylé de la
résorcine et des acides mono et diméthoxy phényl pyruviques il y a cyclisait
on en benzal coumaranone.
Cette série de composés
pourra peut être également servir un jour à identifier les flavanonols qui
restent à découvrir dans la nature et qui pourront être transposés en
benzal-3 coumaranones-2.