Thèse de Cristallographie
présentée à la Faculté des sciences de l'Université de Paris
pour obtenir le grade de
Docteur de 3ème cycle
par
Jean Paul Mornon
Etude
radiocristallographique d'une structure non centrée :
"9-acétoxyroyléanone"
soutenue en juin 1965
devant la commission
d'examen :
Wyart, J., président
Curien, H., Von Eller, G., examinateurs
INTRODUCTION
L'arbuste
vivace Inula royleana, DC croît dans l'Himalaya occidental entre 2100 et
3400 mètres d’altitude. On le considère comme dangereux et il est utilisé pour
ses propriétés insecticides et désinfectantes. Ses racines sont riches en
dérivés de l'alcaloïde diterpénique lycoctonine ; en plus il existe un
pigment jaune, mélange de plusieurs quinones diterpéniques appelées
"royléanones" par trois chercheurs canadiens auteurs de l'étude
chimique de ces composés.
Voici les principaux résultats de leurs analyses : le
composant le plus important de ce mélange est une acétoxyroyléanone C22O5H30,
les deux autres étant la royléanone C20O3H28 et une déhydroroyléanone C20O3H26.
Dans un premier stade d'analyse ils ont pu prouver que la royléanone était une
hydroxybenzoquinone, et deux possibilités s'offraient alors : 
La
synthèse de la royléanone par oxydation du ferruginol permit d’assigner à la
royléanone la formule 1 et aux deux autres composés les formules
suivantes :
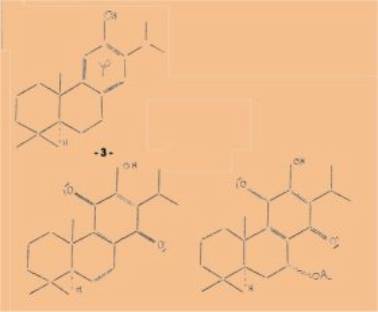
Les
royléanones ont la même configuration absolue que tous les stéroïdes naturels
et que la plupart des diterpènes. En ce qui concerne la 9 acétoxyroyléanone la
position du groupement, acétoxy n'avait pu être précisée.
Problèmes
de structure chimique posés par le 9 acétoxyroyléanone
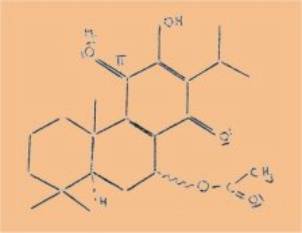
La 9
acétoxyroyléanone est une monohydroxybenzoquinone ; de par son groupement
quinone, elle posséda des électrons non liés n qui sont susceptibles de
subir la transition. Electronique n-p' (orbitale p
antiliante) avec absorption d’une longueur d'onde située dans l’ultra violet
proche (environ 280mm), le
résultat étant la coloration jaune du composé.
Cette
molécule ne doit, en principe, pas posséder de caractère aromatique, les deux
liaisons C=O> de la quinone étant en position de fausse conjugaison. Ce
caractère de non délocalisation des électrons p se traduit en termes de longueurs de liaisons et angles de
valence comme on peut le constater sur les quelques références suivantes :
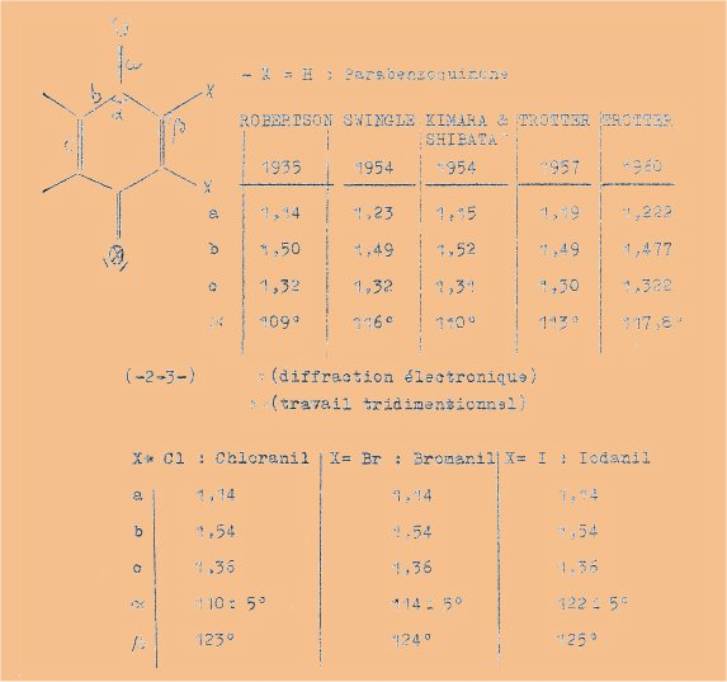
Les
résultats ci-dessus présentent une certaine hétérogénéité, en particulier en ce
qui concerne les angles de valence, surtout en raison des substituants. Le
dernier résultat de TROTTER donne une molécule complètement plane sans
délocalisation des électrons.
Malheureusement,
nous n’avons pu trouver de références pour les hydroxybenzoquinones et en
particulier pour les monohydroxybenzoquinones (qui, peut-être ne sont pas très
stables sans substituants volumineux). En effet on peut envisager à priori
une interaction entre le groupement oxhydryle et le groupement carbonyle
voisin. Il serait alors intéressant de posséder une information sur la
situation de l’hydrogène du groupe OH.
La
position du groupement, acétoxy est difficile à préciser à priori en
raison du caractère presque équatorial et presque axial des substituants de
1’atome de carbone 9 (positions obtenues sur le modèle théorique) et également
en raison du groupement C = O) voisin. L'analyse chimico - physique a laissé ce
point en suspens.
Préalablement
à toute étude aux rayons X, on peut établir 1e schéma suivant de la molécule 9
acétoxyroyléanone :
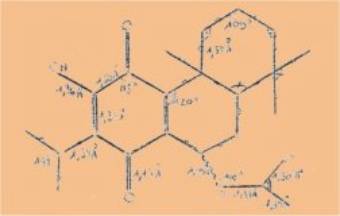
II est à
noter que cette molécule est complètement asymétrique ; l'absence de plan
et de centre de symétrie entraîne la possibilité d’isomérie optique et
l'existence théorique d'une molécule droite et d’une molécule gauche. Ce
composé étant naturel il est probable qu’il n’existe dans cet état que sous une
des deux formes.
Mots clefs : acétoxyroyléanone / analyse / composé / configuration /
déhydroroyléanone / délocalisation / diterpène / électron / étude / ferruginol / formule /
groupement / hydroxybenzoquinone / interation / inula / isomérie / liaison / molécule /
oxhydryle / position / quinone / résultat / royléanone / stéroïde / structure / substituant /
symétrie / synthèse / toylénone / mornon / wyart