Thèse présentée à
l’Université Paris-sud, centre d'Orsay
pour obtenir le grade de
Docteur es sciences
par
Guy Declercq
Action du tétrachlorure de
titane sur les éthers d'énol de béta cétoesters
soutenue en 1978
devant la commission
d'examen :
Conia, J. M., président
Golfier, M., Maitte, P., Mastagli, P., et Molho, D., examinateurs
INTRODUCTION
L'importance des composés à
caractère phénolique dans te règne végétal, a conduit les chercheurs à leur
consacrer de nombreux. travaux. ; tant sur le plan de la détermination des
structures, que sur celui de la synthèse chimique des produits identifiés.
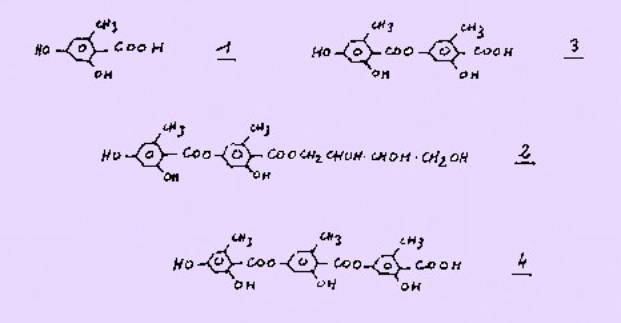
Par exemple, l'acide
ortho-orsellinique 1, isolé à partir d'un champignon : le "Chaetomium
cochliodes » dont différents depsides : l’érythrine 2, l’acide
lécanorique 3, l’acide gyrophorique 4 etc... sont présents dans
les lichens de type "Roccella" et "Lecanora".
De même, l'acide éverninique 5,
isolé à partir de "Evernia Prunastri" ("mousse de
chêne") très utilisé en~parfumerie. Son ester méthylique, le Sparassol 6
produit par le champignon "Sparassis Ramosa» possède quant à lui
des propriétés antibiotiques

Tous
ces corps de la famille de l’orcine posent le problème de leur biogenèse.
Différentes études ont pu. montrer que l'édification du squelette carbone passait
par la condensation d'unités acétiques, pour aboutir à un acide tricétonique,
qui se cyclise par crotonisation interne.

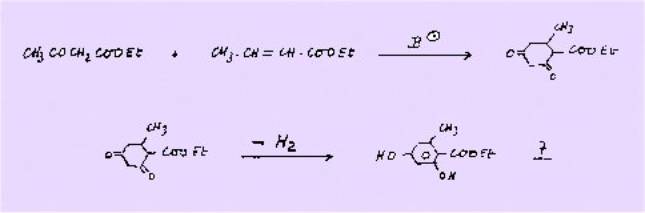
Il restait à synthétiser ces
corps au laboratoire. La première méthode consiste en l’aromatisation du
méthyl-2 cyclohexane dione 4-6 carboxylate d'éthyle provenant de l'addition de
l’acétylacétate d’éthyle sur l’ester crotonique selon une réaction de type
MICHAEL. On obtient ainsi l’ortho orsellinate d’éthyle 7.
Le dicétène
également, réagit sur l’acétylacétate d'éthyle en milieu basique, pour
conduire au même composé

Plus récemment, on
a pu obtenir l’ortho orsellinate de méthyle 8 par condensation du
dianion de l'acétylatacétate de méthyle sur le monoanion du. même ester.

Quant à nous,
notre intérêt s’est porté sur l’autocondensation des éthers d'énol de Beta Ceto
esters en milieu, acide et sur l’utilisation du tétrachlorure de titane comme
catalyseur de cette réaction.
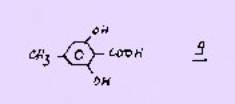
Nous avons
ainsi pu. préparer les dérivés de l’acide ortho orsellinique 1 et également
ceux. de l'acide para orsellinique 9 isomère du précédent qui lui, n'a pu être mis
en évidence comme constituant de produits naturels.
L'obtention de.
ces dérivés se fait sélectivement suivant la. nature et la structure
de l’éther d’énol utilisé.
En dehors de
leur utilisation comme blocage des carbonyles, les éthers d'énol de Beta. Ceto
esters n'ont pas fait l'objet d'études très approfondies.
Citons
simplement BLAISE qui fait agir sur l’éthoxy-3 crotonate d’éthyle, un dérivé
organomagnésien pour obtenir une cétone éthylénique.
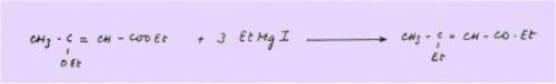
Et DEAN,
STEELINK et TETAZ qui utilisent le carbanion obtenu par arrachement
d'un proton en position "4" pour des réactions de type CLAISEN
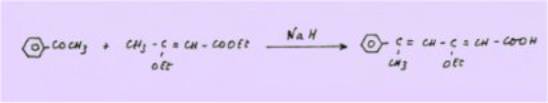
Quant au
tétrachlorure de titane, en plus de son utilisation comme catalyseur doux
dans la réaction de FRIEDEL et CRAFTS et de son rôle industriel fondamental
dans les réactions de polymérisation cationique, il a souvent permis
d’observer des réactions originales.
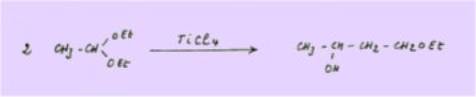
Q’il suffise
de rappeler ici les travaux de P. MASTAGLI et de ses collaborateurs qui condensent les
acétals en monoéthers de diols 1-3.
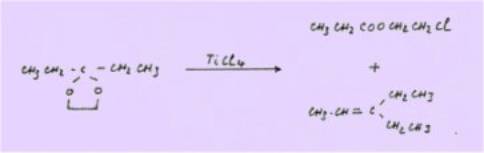
Ou qui, à
partir de dioxolanne obtiennent un carbure éthylénique et un ester.
Plus récemment, T. MUKAIYAMA et son équipe ont grandement
développé l’action de ce réactif particulier. Signalons des réactions
d’aldolisation.
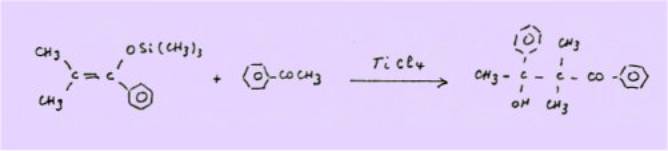
Et l’utilisation des acétals activés par le tétrachlorure
de titane pour des réactions de condensation, sur le dicétène par exemple.

Nos travaux conduisant à l’obtention d’acides diphénol à
partir d’éther d’énol constituent une extension de la réactivité particulière
du tétrachlorure de titane. Le schéma réactionnel s’apparente en effet à une
réaction de MICHAEL en milieu acide.
Nous avons
divisé cette étude en trois parties. La première plus théorique nous permettra
de définir pour chaque réaction-type, ses limites et son champ d’application.
Une
détermination soigneuse des structures obtenues conduira à l’élaboration d’un
mécanisme réactionnel qui tient compte des résultats observés.
Dans un
deuxième temps, nous appliquerons à de nombreux éthers d’énol, les différentes
possibilités de condensation, ce qui nous conduira à la synthèse d’un certain
nombre d’acides diphénol, nouveaux pour la plupart.
Enfin, il nous
a paru nécessaire de regrouper dans une troisième partie, la synthèse des
éthers d’énol utilisés, de façon à généraliser les méthodes particulières
disponibles dans la littérature et à en constituer une certaine mise au point.