Thèse
de Pharmacie présentée à Faculté de pharmacie de l'Université de Paris
pour
obtenir le grade de Docteur de l'Université
par
Jean-Cyr
Gaignault
Réactions
de cyclisation de l'acide glyoxylique ou de ses esters avec les catécholamines
et certains de leurs analogues synthétiques
INTRODUCTION
L'acide glyoxylique —que l'on appelle parfois aussi glyoxalique, et que l'on devrait
appeler éthanaloïque — est connu depuis plus d'un siècle. En effet, c'est en 1856 que
DEBUS l'isola parmi les produits de l'oxydation de l'alcool éthylique sous
l'influence de l'acide nitrique. Mais ce n'est qu'un demi-siècle plus tard,
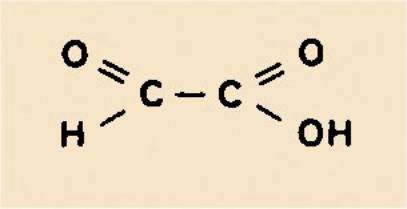
en 1905, qu'il détermina définitivement sa structure si particulière, en montrant que
c'était le plus simple des acides-aldéhydes :
La juxtaposition de ces deux fonctions confère à la molécule de l'acide glyoxylique
une très grande réactivité et lui permet d'entrer dans de multiples réactions de
condensation. En raison de cette réactivité et de sa taille réduite, il n'est
pas étonnant que cette substance intervienne comme intermédiaire dans la
plupart des métabolismes de la cellule vivante et qu'elle ait attiré ainsi depuis
longtemps 1’attention des biochimistes. Les chimistes organiciens s'y sont
moins intéressés pour la raison très simple que, jusqu'à ces dernières années, il n'était fourni par
l'industrie que sous la forme d'une solution aqueuse, plus ou moins
concentrée et plus ou moins pure, et que sa préparation au laboratoire à
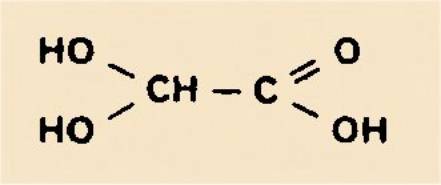
l'état pur est assez délicate. Ce n'est que depuis quelques années que l'acide
glyoxylique monohydraté cristallise est un produit commercial :
C'est en cherchant à préparer, à l'aide de ce produit pur, le sel de l'acide glyoxylique
et d'un médicament, voisin des catécholamines, de la forme
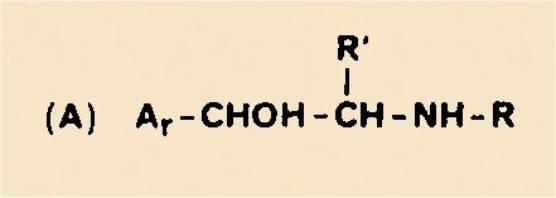
que la réactivite de l'acide givoxylique s'est imposée à notre
esprit. En effet, le composé cristallisé obtenu par un bref contact a froid,
en solution alcoolique
ou même aqueuse, de i mole d'acide et i mole d'aminoalcool (A) n'était pas le sel
attendu A, (HO)2CH-COOH = A, C2H4O4 mais un produit de condensation de formule brute
A(C2O2), ayant donc perdu deux molécules d'eau.
Il nous a semblé intéressant d'étendre cette réaction à d'autres substances
d'intérêt thérapeutique, la norphényléphrine et la noradrénaline ainsi que
leurs dérivés N-substitués, et de déterminer les structures des produits obtenus.
Les deux fonctions aldéhyde et acide carboxylique de l'acide glyoxylique sont a
priori susceptibles de réagir, non seulement avec les deux fonctions aminé et alcool
de l'aminoalcool, mais aussi avec l'un des chaînons du noyau benzénique,
activé par 1 ou 2 OH aromatiques. La formule brute A.(C2O2) pouvait donc
correspondre à l'une des structures suivantes : 1) Acide
imino-acétique (base. de Schiff). avec les aminés primaires :
-2 :
La formation d'oxazolidines par réaction des aldéhydes avec les aminoalcools est
connue depuis longtemps.
3) Hydroxy-2 morpholinone-3 :
et formes tautomères ou isomères
Des hydroxymorpholinones de ce type ont été obtenues par condensation
du phénylglyoxylate d’éthyle avec des aminoalcools
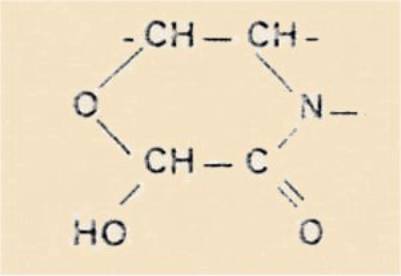
4) Acide dihyroxy-4 ,6 (ou 4,8) tétrahydroisoquinaldique :
5) Trihydroxy-1 ,5,7 tétrahydroenzaeépine-3 one-2 (ou –benzo
[d] azépine-2) :
Une molécule d'acide glyoxylique pourrait aussi réagir avec deux molécules d'aminé
pour donner, soit un
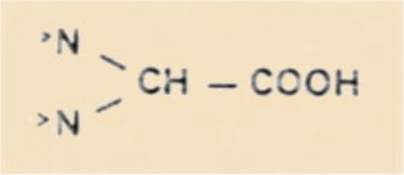
6) Acide diaminoacétique (animal) :
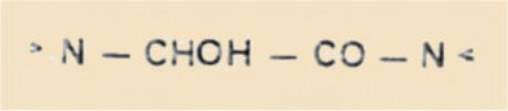
7) Hémiaminal-amide :
Nous avons seulement isolé à partir des hydroxy-3 et dihydroxy-3,4 phenyléthanolamines
les structures 4 et 5. Mais nous avons en cours d'autres travaux qui nous permttent
de prévoir que les autres structures imaginées peuvent être obtenues dans des
conditions analogues avec des substances voisines.
Nous verrons que le produit de la réaction de la phényléphrine avec l'acide
glyoxylique, dans les conditions indiquées plus haut est le même acide
tétrahydroisoquinaldique qu'aurait fourni la rféaction de PICTET et
SPENGLER. Une réaction semblable a été décrite tout récemment par KAMETANI et ses
collaborateurs, travail parvenu seulement à notre connaissance au cours de la
rédaction de nos résultats : il s'agit de la condensation aisée des (hydroxy-3
phenyl) éthyl- et -éthanolamines avec les aldéhydes et les cétones en tétra- hydroisoquinoléines
substituées en -i. Cette réaction a lieu en l'absence d'acide fort, à la
différence de celle de PICTET et SPENGLER ; pour la distinguer de celle-ci, les auteurs
japonais la dénomment «cyclisation phénolique».
Nous adopterons cette terminologie pour désigner, non
seulement les réactions où le carbone aldéhydique de l'acide glyoxylique
participe à la fermeture du cycle d'un acide
tétrahydroisoquinoléine-carboxylique-i, mais aussi celles où, comme nous le
verrons, ses deux atomes de carbone entrent dans le cycle d'une hydroxy-i
tétrahydrobenzazépine-3 one-2.
Notre travail sera divisé en quatre parties :
i° Dans la première partie, nous passerons en revue les
nombreux travaux des biochimistes qui ont permis de préciser le rôle de
l'acide glyoxylique dans différents métabolismes des êtres vivants.
2° La deuxième partie sera consacrée à la description des
réactions que nous avons observées et des produits obtenus, et à
l'établissement de leurs structures à l'aide de procédés chimiques et de procédés
physiques. Parmi ces derniers figurent en première place les spectres d'absorption
infra-rouge (I.R.) et les spectres de résonance magnétique nucléaire (R.M.N.).
3° Nous exposerons les détails expérimentaux dans la troisième partie.
4° Dans la quatrième partie, nous traiterons de l'étude
pharmacologique des produits obtenus, dont certains ont manifesté des
propriétés intéressantes, telles qu'une activité antitussive.
Nous avons passé en revue dans la première partie de ce
travail les nombreuses recherches biochimiques effectuées sur l'acide
glyoxylique, qui ont montré que cet acide dicarboné - le plus simple des acides-aldéhydes -
est un métabolite important, aussi bien dans le règne végétal et les microorganismes
que dans le règne animal, et qu’il était capable d’inhiber plusieurs enzymes, notamment
parmi celles
qui régissent les cycles respiratoires.
Notre étude de ces travaux nous a amenés à tenter d'associer dans un but
thérapeutique, l'acide glyoxylique à certaines substances médicamenteuses.
Ainsi, cherchant à préparer le sel glyoxylique d'un médicament aminé,
voisin des catécholamines, par simple contact avec 1’acide glyoxylique
monohydraté, nous avons obtenu, dans des conditions «physiologiques», un composé qui
n'était pas le sel attendu mais le produit de la condensation équimoléculaire des
constituants avec perte de deux molécules d'eau.
Il nous a paru intéressant d'étendre cette réaction aux
catécholamines elles-mêmes et à leurs analogues synthétiques. Nous nous sommes limités ici
à l'étude des réactions de condensation entre quelques hydroxy-3 et dihydroxy-3,4
phényléthanolamines (norphényléphrine et noradrénaline et leurs dérivés
N-substitués) et l'acide glyoxylique et ses esters.
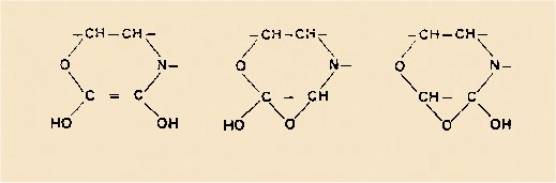
Plusieurs structures isomères étaient compatibles à la fois
avec la composition élémentaire des produits obtenus et avec la nature des produits de départ.
A l'aide de procédés chimiques (préparation de dérives, dégradation) et physiques
(chromatographie en couche mince spectrographies I.R. et R.M.N.), nous avons
pu démontrer dans la deuxième partie que, grâce à sa réactivité particulière,
l'acide glyoxylique (ou ses esters) cyclise les aminoalcools considérés,
formant des hétérocycles azotés où interviennent, soit son carbone aldéhydique seul (cycle
isoquinoléine), soit ses deux atomes de carbone (cycle benzazépine) : les hydroxy-3
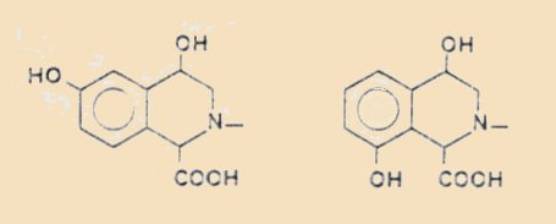
phényléthanolamines conduisent avec l'acide glyoxylique aux isomères cis
et trans des acides dihydroxy-4,6 tétrahydro-1,2,3,4
isoquinoléine-carboxyliques-i combinés l'un à l'autre sous la forme d'un
sel réciproque très stable, et les dihydroxy-3,4 phényléthanolamines aux
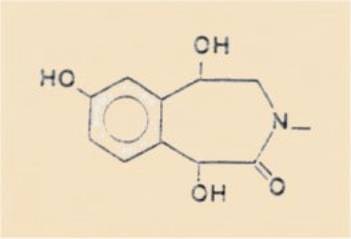
tétrahydroxy-1,5,7,8 tétrahydro-2,3,4,5 1 H-benzazépine-3 ones-2, accompagnées
ou non (selon la nature du substi-tuant à l'azote) des sels réciproques des
acides cis- et trans-trihydroxy-4,6,7
tétrahydroisoquinoléine-carboxyliques-i. Les esters de l'acide glyoxylique
réagissent d'une manière analogue.
Nous avons précisé dans la partie expérimentale les modes de
préparation et les caractéristiques physico-chimiques des produits de condensation
obtenus.
Enfin nous avons soumis ceux-ci à une étude pharmacologique préliminaire qui a
révélé pour certains d'entre eux, notamment pour le produit de la réaction de l'acide
glyoxylique avec la phényléphrine, des propriétés antitussives marquées,
comparables à celles de la codéine aux mêmes doses ; il faut noter que,
contrairement à celle-ci, ce composé est pratiquement atoxique, qu'il a une action très
faible sur la musculature bronchique et qu'il est sans action sur l'intestin.
En outre, nous avons été frappés par cette même absence de
toxicité, et aussi par la très faible activité hypertensive manifestée par les produits de
condensation avec les catécholamines, qui n'est sensible qu'à des doses très
fortes, environ mille fois supérieures aux doses hypertensives de l'adrénaline ou de
la nordrénaline.
Or l'acide glyoxylique est un constituant normal de
l'organisme vivant, susceptible de coexister avec les catécholamines dans
certains tissus, et nous avons montré qu'il se condense avec elles très
rapidement, en solution aqueuse et à la température ordinaire, autrement dit dans des
conditions physiologiques. Cela nous a amenés à formuler l'hypothèse que les
réactions que nous avons étudiées pourraient constituer un mécanisme physiologique,
non-enzymatique, utilisé par l'organisme pour détoxiquer les catécholamines, parallèlement
aux mécanismes
enzymatiques connus. S'il en était ainsi, les produits de condensation
pourraient eux-mêmes à leur tour jouer un rôle physiologique. Cette hypothèse
est à rapprocher de celle émise par CORRODI et HILLARP dont nous avons cité plus haut
les travaux : ces auteurs ayant identifié des dihydro-3,4 et des tétrahydro-1,2,3,4
isoquinoléines parmi les produits de l'action du formol ou de l'acétaldéhyde sur des supports
protéiniques contenant de très faibles quantités de catécholamines (ou
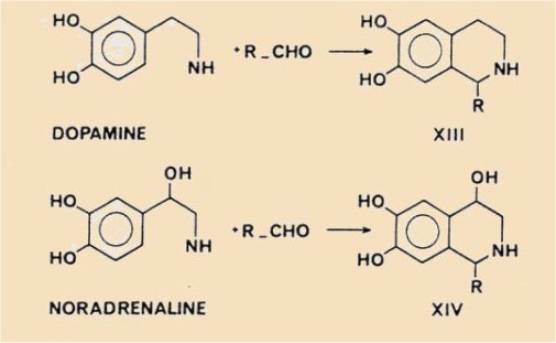
d'autres hydroxy-3 phényléthyl- ou -éthanolamines), s'expriment ainsi : «... la
condensation de la dopamine et de la noradrénaline avec les aldéhydes en
tétrahydroisoquinoléines, qui a lieu à un pH physiologique en un temps extrêmement court,
rend vraisemblable
l'apparition possible de XIII et XIV comme métabolites non enzymatiques,
physiologiques ou pathologiques, respectivement de la dopamine et de la
noradrénaline, par exemple avec l'acétaldéhyde (R = CH3)
Les résultats de nos expériences nous conduisent aux mêmes
conclusions pour R = COOH, c'est-à-dire avec l'acide glyoxylique.
La réaction étudiée par CORRODI et ses collaborateurs est une
des meilleures méthodes
de localisation et de dosage des catécholamines dans les tissus, mais l'action
dénaturante du formol sur les protéines en est un inconvénient. Aussi serait-il
sans doute avantageux de substituer au formol l'acide glyoxylique, dont les produits de
condensation avec les catécholamines que nous avons décrits dans ce travail pourraient être
localisés et dosés par leur fluorescence comme avec le formol. On pourrait
même envisager des essais in vivo où la perfusion d'une solution
isotonique de glyoxylate permettrait de déterminer la quantité, la nature
et la localisation dans les tissus et les humeurs des catécholamines
libérées à la suite de diverses agressions (stress) physiques ou chimiques.
Nous nous proposons d'étudier ce problème ultérieurement. 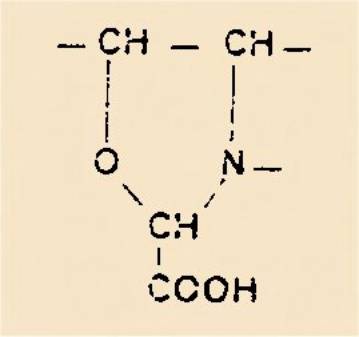
CONCLUSIONS