Thèse
de Pharmacologie moléculaire et cellulaire présentée à l'Université Pierre et
Marie Curie, Paris 6
pour
obtenir le grade de Docteur Ingénieur
par
Véronique
Lelièvre
Inhibition
de b-lactamases de bacilles
gram-négatif par l'acide clavulanique, le CP 45.899 et quelques sulfones de
pénicillines
soutenue
le 2 juillet 1980
devant
la commission d'examen :
Blangy,
D., président
Cadiot, P.,
Torossian, R., Labia, R., et Le Goffic, F., examinateurs
GENERALITES
Certaines classes de maladies
correspondent à des perturbations du métabolisme de substances biologiquement importantes
(transmetteurs syraptiques, hormones, polypeptides, divers
véhicules de l’information à travers l’organisme). Ces
perturbations peuvent être la conséquence d’une «agression" extérieure à
1’organisme ou d'une déficience momentannée ou définitive de l'organisme
lui-même.
Si la cause primaire de la
maladie n’est pas curable (et c’est souvent le cas), une thérapeutique pourra
consister à rétablir des taux "normaux" de ces substances
biologiquement importantes en induisant, par une drogue convenable, des
perturbations aux conséquences inverses de la perturbation initiale.
Dans cette optique, les enzymes
semblent alors être une cible de choix, et il existe actuellement de nombreuses spécialités qui
se sont avérées être des inhibiteurs enzymatiques.
Sans vouloir être exaustif nous allons examiner quelques
exemples de médicaments de ce type qui ont particulièrement retenu notre
attention.
Dans le domaine du
cardio-vasculaire (hypertension) et du système nerveux central
(dépression), les inhibiteurs enzymatiques ont été très étudiés : inhibiteurs de
la monoamine oxydase, certains sont compétitifs, réversibles comme l’hydralazine,
d’autres irréversibles comme la phénelzine et la pargyline.
Un autre exemple est le
traitement des maladies inflammatoires, processus dans lequel les
prostaglandines jouent un rôle de médiateur. On administre de 1'indométhacine
qui inhibe la cyclo-oxygénase, (responsable de la biosynthèse des prostagiandines)
de façon dépendante de la concentration, progressive avec le temps et
irréversible.
A ce propos, il faut noter que
souvent le problème est très compliqué. Bien souvent, on a administré les
médicaments avant de connaître exactement leurs effets biochimiques ; la cible
réelle du médicament n'est pas toujours facile à mettre en évidence.
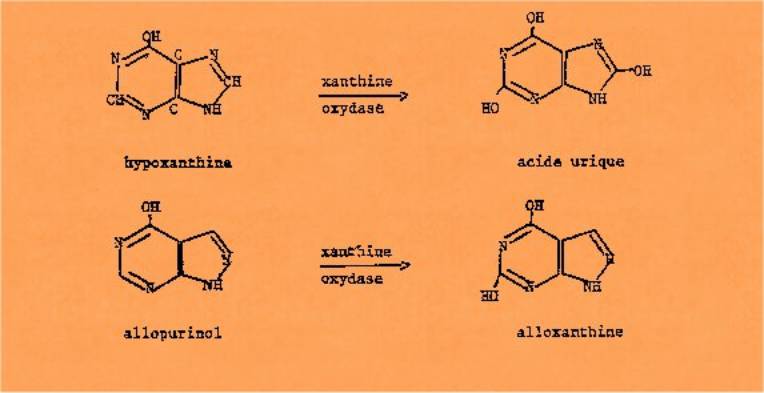
En dehors de la colchicine, un
autre médicament du traitement de la goutte, l'allopurinol, est aussi un
inhibiteur. enzymatique. Il agit sur la xanthine oxydase et empêche, dans le
processus de dégradation des purines, la formation d'acide urique (lequel
précipite lorsque sa concentration est trop élevée et provoque l'inflammation)
à partir de l'hypoxanthine. C'est un isomère de ce dernier.
De très nombreux médicaments
anti-cancéreux sont également des inhibiteurs enzymatiques. Ils agissent au
niveau de la biosynthèse des acides nucléiques. La répercussion étant l'arrêt de la
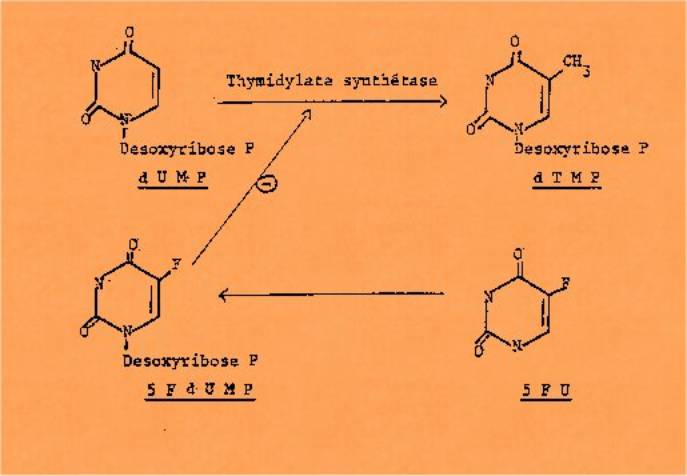
synthèse d'ADN dans les cellules tumorales. Si le méthotrexate, en inhibant la
dihydrofolate réductase (c'est un analogie du substrat), risque de
bloquer beaucoup d'autres voies métaboliques (biosynthèse des purines), par contre le
5-Fluoro-uracile a un effet plus spécifique ; il n'est pas actif par lui-même
mais son métabolite le 5-Fluoro-desoxyuridine phosphate est un inhibiteur
compétitif de la désoxyuridine phosphate au niveau de la
thymidylate synthétase.
Aujourd’hui même, certains
laboratoires sont à la recherche d'inhibiteurs irréversibles d'enzymes
à pyridoxal = décarboxylase ou transaminase telle que l'ornithine décarboxylase (pour
le traitement des tumeurs cancéreuses), la dopamine décarboxylase (AADC) (pour
le traitement
de l'hypertension) et la GABA transaminase.
Ces dernières années, la
littérature a rapporté la structure de plusieurs molécules décrites comme étant
plus ou moins des inhibiteurs de b-lactamases. Ce point est
souvent décrit de façon extrêmement succinte et on dispose le plus
souvent de très peu de données expérimentales permettant de justifier cette
propriété.
L'acide clavulanique est
certainement le plus connu à en juger par le nombre de publications et de
communications dont il est l’objet. Parmi ceux-ci, se trouvent 7 ou 8 articles
relatifs à l’aspect enzymatique de l’inhibition induite par ce produit, qui
viennent confirmer que l’acide clavulanique est bien un inhibiteur de b-lactamases.
Par
contre, la littérature est bien plus discrète sur les autres inhibiteurs
d’origine naturelle.
A la suite du CP45.899, deux
autres inhibiteurs hémi-synthétiques de b-lactamases ont
été décrits en 1979 : l’acide-6-b-bromo-pénicillanique
et la 6-a-chloro sulfone de l’acide
pénicillanique, produits qui sont à l’origine de nombreuses discussions.
Malheureusement
comme c’est souvent le cas, pour ces deux dernières substances, on ne dispose,
pour ainsi dire, pas de données cinétiques.
Depuis, a été décrite la
structure d'un ester de l'acide clavulanique (hydroxy 3 propyl) qui serait un inhibiteur
de céphalosporinases.
L'évaluation réelle ou
comparative de ces diverses substances est totalement impossible car souvent
ces substances ne sont pas disponibles.
Nous avons cependant pu disposer
de l'acide clavulanique et de la sulfone de l'acide pénicillanique que nous avons
étudiés de façon aussi approfondie que possible vis-à-vis de plusieurs b-lactamases. Un point
important restait à approfondir : pourquoi ces substances sont-elles
inhibitrices de b-lactamases ?
.
Cette propriété est-elle liée à l'absence de substituant en C6 ? (ce qui
semblerait en contradiction avec la structure de l'acide bromopénicillanique et
de la chlorosulfone correspondante).
. Cette propriété est-elle liée au remplacement du soufre du noyau par un
élément chimiquement plus réactif : sulfone ou éther d'énol ?
Ceci explique les raisons pour
lesquelles nous avons étudié différentes sulfones de pénicilline en comparaison avec
leur molécule-mère et le CP 45.899 avec l'acide pénicillanique.
Ainsi, nous avons constaté que
les b-lactamases présentent toujours des affinités
beaucoup moins bonnes pour les sulfones de pénicillines G, oxacilline et
méthicilline que pour les homologues non oxydés. Par contre, la fonction sulfone
semble favoriser l'hydrolyse.
C'est un phénomène totalement
différent qui s'observe pour le CP 45.899 qui est reconnu de façon très exceptionnelle
par ces enzymes mais qui est plus difficilement hydrolysé.
La seule fonction sulfone ne
peut donc expliquer la particularité de la sulfone de l'acide pénicillanique.
Il semble que les deux facteurs
: absence de substituants en C6 et oxydation en sulfone soient corresponsables de la
capacité d'inhibition.
Les sulfones de pénicilline G,
oxacilline et méthicilline ne permettent pas de synergie lors de l'association avec
l'ampicilline pour les pénicillinases plasmidiques ni avec la céphalotine pour
les céphalosporinases
chromosomiques (ceci semble être lié à des problèmes spécifiques de
pénétrations de ces molécules dans les bactéries).
Nous comprenons donc qu'à l'heure
actuelle, l’intérêt se soit focalisé sur la sulfone de l'acide pénicillanique.
Nous venons de mettre en
évidence les caractéristiques de l’inactivation des b-lactamases par
la sulfone de l'acide pénicillanique (CP 45 899) qui sont les mêmes que celles
observées avec l'acide clavulanique : inhibition compétitive et dépendante du
temps.
II est certain que nous n'avons
pas eu les moyens de démontrer réellement l'irréversibilité de phénomène
d'inactivation ; cependant, nous estimons suffisante la stabilité du complexe
formé (aucune
réversibilité n'est observée pendant 30 mn), étant donnée la vitesse de
croissance des bactéries : duplication intervenant pour des temps
de l'ordre de 20 mn (dans des conditions de milieu favorable).
C'est cette rapidité de
reproduction des bactéries qui devrait guider impérativement le choix de l'inhibiteur k
cat à utiliser
: l'inhibiteur ne pouvant être intéressant que si le temps de
demi-inactivation est court, c'est-à-dire de l'ordre de la minute.
Dans le cas de pénicillinases
plasmidiques et de la céphalosporinase de P. vulgaris, le clavulanate, alliant
bonne affinité
des enzymes, temps de demi-inactivation inférieur à 30 s et "turnover
number" relativement bas, a effectivement de bonnes propriétés
synergistiques lors de l'association avec l'ampicilline.
Pour le CP 45 899, le tableau se
présentait moins favorablement : bonne affinité des enzymes mais temps de
demi-réaction de l'ordre de 10 mn et grands "turnover numbers" et
pourtant ce composé manifeste des synergies avec l'ampicilline.
Il semble donc qu'alors le CP 45
899 agisse plutôt en tant qu'inhibiteur compétitif qu'en tant qu'inhibiteur k. cat.
Il semble donc qu'il ne faille
pas se limiter obligatoirement à la propriété d'inhibition progressive dans le temps. Les
propriétés globales d'une molécule ne sont, en général, que le reflet de
ces différents
paramètres dont on ne peut prédire quel est le plus fondamental.
Ainsi dans le cas du P.
morganii, on observe une synergie intéressante avec le CP 45 899 (temps
de demi-réaction de 10 secondes) tandis que l'acide clavulanique est
totalement inefficace (t 1/2=3 min). Vis-à-vis de cette enzyme, l'acide
clavulanique présente une affinité très mauvaise ce qui expliquerait,
peut-être, les faits expérimentaux.
Par contre, les
céphalosporinases de E. coli et P. rettgeri apparaissent comme résistantes aux
produits testés.
Bien évidemment, les intérêts de
telle ou telle molécule seront à moduler selon leurs propriétés
pharmacocinétiques, pharmaco-dynamiques et leurs toxicités.
L'arrivée récente d'une
"nouvelle" génération de eéphalosporines (ou de molécules assimilées)
(céfotaxime, céfsulodine, céfmetazole, FR 749, céfoperazone, Ly 127.935,
céfotiam, GR 20 263...), qui sont des antibiotiques considérablement plus actifs
que les céphalosporines classiques, pourrait reposer la question de
l'intérêt des inhibiteurs de b-lactamases.
En effet, ces substances
répondent, en principe, parfaitement aux critères de résistance aux b-lactamases
tels que les a définis Richmond qui ne tient compte que du Vm, mais l'intérêt de
cette approche est très critiquable
Cependant, nous savons que le
terme "résistance aux b-lactamases implique
essentiellement que la molécule présente un rapport T = Km/Vm (proportionnel
à la demi-vie de l’antibiotique aux faibles concentrations) assez grand.
Vis-à-vis de ce critère, les nouvelles céphalosporines sont souvent moins
stables que le seul examen du Vm pourrait le laisser penser.
Diverses considérations qu'il
serait trop long d’exposer ici, permettent de montrer que de telles hydrolyses
présentent une signification physiologique.
En d'autres termes, dans de
nombreuses souches résistantes à certaines nouvelles céphalosporines, cette résistance
trouve sa justification au niveau d'une forte production de b-lactamases (céphalosporinases).
Le concept d'inhibiteur de b-lactamase
garde donc toujours sa valeur et dans le cas de ces nouvelles céphalosporines,
nous manquons
très certainement d'inhibiteur de céphalosporinases.
Un "design" rationnel
de telles molécules est-il possible ? Peut-être, mais nos études concernant
nos dérivés de sulfone semblent aller en sens inverse.
Dans cet ordre d'idée, nous
avons constaté qu'une oxa-céphalosporine (LY 127.935), qui est douée de
propriété antibactérienne fort intéressante, présente également un effet inhibiteur,
progressif dans le temps, des céphalosporinases.
Ce dernier aspect justifierait,
peut-être, les propriétés particulières de cette molécule.
Nous pensons qu'à l'avenir, les
inhibiteurs de b-lactamases trouveront une
place importante au niveau thérapeutique en dépit du fait que ce
concept d'inhibition soit relativement ancien et n'ait été que tardivement
développé.
MOTS CLEFS :
acide / sulfone / lactamase / inhibiteur / propriété / molécule / pénicillanique /
clavulanique / céphalosporinase / enzyme / céphalosporine / résistance / médicament /
inhibition / traitement / affinité / synergie / structure / pénicilline / organisme /
maladie / décarboxylase / concentration / biosynthèse / bactéries / ampicilline / transaminase
/ réaction / purine / prostaglandine / phosphate / phénomène / pénicillinase / oxydase /
oxacilline / origine / méthicilline / hypertension / fonction / désoxyuridine / association /
antibiotique / blangy