Thèse présentée à la
faculté des sciences de l'Université de Lyon
pour obtenir le grade
de Ingénieur-docteur
par
Jacques
Aknin
Sur la condensation des bases de Mannich phénoliques avec
les composés aromatiques hydroxylés et aminés
soutenue le 3 mars
1962
INTRODUCTION
La réaction
dite de MANNICH peut être considérée comme la condensation, soit de
l'ammoniaque, soit des aminés primaires ou secondaires sous forme de bases
libres ou de chlorhydrates avec certains composés à hydrogène mobile, en
présence d'aldéhydes et plus particulièrement de formol.
Alors qu'un
grand nombre d'auteurs accordent à VAN MARLE et TOLLENS, qui partent d'une
cétone, la première de ces réactions, on peut faire remonter à 1895 l'origine de
ces bases.
En effet, le
11 Mars 1895, la FARBENPABRIKEN BAYER & C° dépose un brevet concernant la
condensation des phénols et des naphtols avec les aminés secondaires en présence
de formol et prétend aboutir à des éthers aminométhyliques en raison de leur
insolubilité dans la soudes :
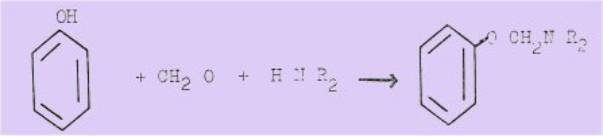
Deux autres
brevets pris par la même fabrique en 1895 et 1896 ont trait à ces
réactions.
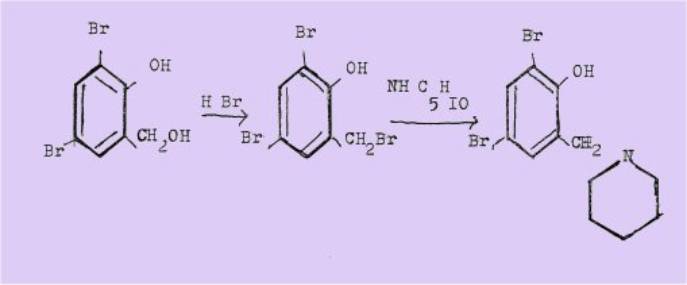
En 1900,
HILDEBRANDT démontre que ces dérivés, les phényl-aminométhyl-éthers, sont en
réalité des dialkyl-aminométhyl-phénols en identifiant le produit de .la
condensation du dibromo-2,4 phénol à celui obtenu par AUWERS et BUTTNER par
traitement du bromométhyl-6 dibromo-2,4 phénol par la
pipéridine :

En 1906,
AUWERS et DOMBROWSKY étendent cette réaction à d'autres
phénols, en utilisant plus particulièrement, comme aminé secondaire,
la pipéridine qui donne des produits cristallisés.
Il nous faut
donc admettre que, contrairement à ce qui avait été affirmé
jusqu'alors, la première de ces réactions y dite de MANNICH, a
été appliquée à des phénols.
Cependant,
aucun des auteurs n'avait étendu la méthode à d'autres
composés à hydrogène mobile; c'est le grand mérite de MANNICH
d'avoir entrepris cette généralisation. En 1912, il dépose un brevet
concernant la préparation de la diméthylaminobutanone-2 d'après le
schéma suivant:
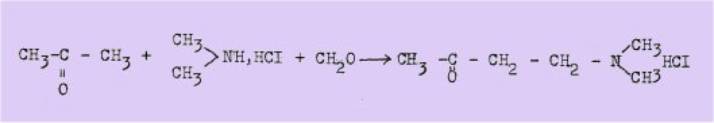
et
ultérieurement applique la méthode à un grand nombre de composés ayant au
moins un hydrogène activé.
Guidé par le
fait que ces réactions s'effectuent généralement dans des conditions très
douces, proches des conditions biologiques, MANNICH suppose en 1917 que la
préparation et la biogenèse des composés
azotés naturels pourraient s'effectuer selon un processus analogue.
Nous avons pu lire en effet, dans une de ses publications, les phrases
suivantes : "Devant
l'intérêt que présente la biologie des plantes, il n'a pas paru sans
espoir d'obtenir des composés naturels assez compliqués à partir du
mélange de formaldéhyde et du chlorure d'ammonium. On peut
admettre que la plante a à sa disposition le formol et des sels d'aminés
simples ou d'ammoniaque, comme ces solutions formoliques des
sels d'ammoniaque donnent très facilement avec de nombreux composés des produits
de condensation compliqués dans lesquels l'azote du sel d'ammoniaque se retrouve
dans une liaison organique, la possibilité que la plante utilise cette voie de
synthèse pour former des corps azotés compliqués n'est pas exclue."
Et, plus
loin
« II me
parait surtout intéressant (d'envisager) la formation des dérivés pyridiniques à
partir du sel d'ammoniaque du formol et des cétones aliphatiques. Peut-être la
plante construit-elle à partir de ces matières premières les noyaux pyridiniques
qu'on retrouve dans les alcaloïdes".
L'hypothèse
de préparation "in vitro" des composés azotés naturels, par cette voie a été
confirmée et vérifiée par les travaux de SOHOP et COLL., de BUCK et COLL. et de
REICHERT et HOFFMANN.
Quant à la
biogenèse des alcaloïdes, WOODWARDT envisage et propose cette possibilité
réactionnelle, bien qu'elle nous semble à priori
improbable.
Partant donc
de cette intuition dynamique, MANNICH et son école appliquent par la suite ce
type de condensation à un grand nombre de composés qu'on peut diviser en trois
groupes :
a)
Les composés
ayant des hydrogènes activés par des groupements fonctionnels comme les
aldéhydes, les acides mono.-, di-, et tricarboxyliques, les cétoacides, les
groupements nitro, etc... qui donnent la fixation du groupe aminométhyle sur le
carbone en - a
b)
les composés
hétérocycliques comme le thiophène, les indoles, les chromones, etc..., où la
substitution se fait sur le carbone dont l'hydrogène est activé par
1'hétéro-atome.
c)
certains
dérivés azotés comme ; le phtalimide, le succinimide, l'acide benzhydroxamique,
le benzimidazole, etc.... qui donnent l'enchaînement = N - C - N = par fixation du radical aminométhyle sur
l'azote.
En raison de
l'impulsion- et de la généralisation que MANNICH a donné à la réaction, le nom
générique de "BASES DE MANNICH" a été attribué aux dérivés
obtenus.
Pour notre
part, nous nous sommes tout spécialement intéressés aux bases de MANNICH
obtenues à partir des phénols en raison de leurs applications ; en effet,
nous avons pu constater que les bases de MANNICH ont été préparées dans deux
buts principaux :
I)
Application directe soit
thérapeutique soit industrielle
C'est ainsi
que certaines de ces bases ont été préparées, puis
étudiées en raison de leurs activités physiologiques comme antimalarique
par exemple, ou en vue d'obtenir des sels solubles
facilement administrables.
Dans
l'industrie, elles ont été utilisées comme stabilisant de
vulcanisation ou comme résines échangeuses d'ions après quaternisation.
2)
Utilisation en synthèse organique
C'est ainsi
que par hydrogènolise de certaines d'entre elles, ont a pu
réaliser la méthylation sélective de noyaux phénoliques nécessaires par exemple
dans la synthèse de la vitamine E, ou encore la préparation du diméthyl-é? 17
hyd'roxy-3 morphinane à partir du méthyl-17
morphinane
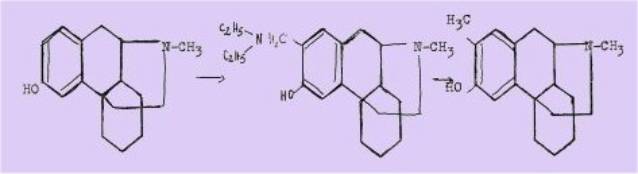
Elles sont
également utilisées comme agent d'alkylation; par exemple, le traitement de
l'acide cyanhydrique par la base de MANNICH du naphtol-2 conduit à l'acide
hydroxy-2 naphtylacétique
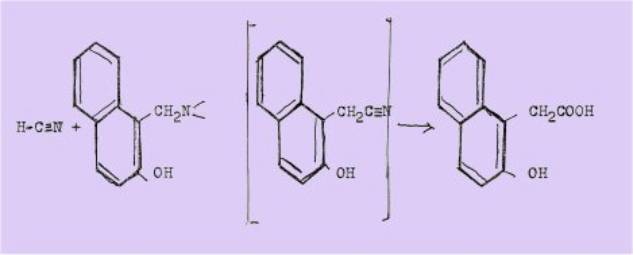
Nous aurons par ailleurs
l'occasion d'exposer d'autres réactions d'alkylation des bases de MANNIOH
phénoliques.
Ces bases
présentent donc d'après les quelques exemples précédents un intérêt
considérable; aussi nous sommes nous attaché à développer leur préparation et
quelques unes de leurs propriétés par la mise au point de nouvelles méthodes de
synthèse et par leur emploi comme agent d'alkylation de composés qui n'avaient
pas été envisagés ; phénols et aminés aromatiques que nous avons considérés
comme composés à hydrogène mobile.
Le plan de
ce travail est le suivant :
Premier
chapitre : Préparation et mécanisme d'obtention des bases de MANNICH
phénoliques.
Deuxième
chapitre : condensation de ces bases avec les phénols. Obtention de
dihydroxy-2,2' diarylméthanes symétriques et dissymétriques.
Troisième
chapitre : condensation de ces mêmes bases avec les aminés aromatiques
mono- et polycycliques
a)
Nouvelle
préparation de benzoacridines.
b)
Obtention de
nouveaux composés : les amino-2 hydroxy-2' diarylméthanes. Etude de
quelques-unes de leurs propriétés.
c)
Nouvelle
méthode de préparation des benzoxanthènes.
CONCLUSIONS GENERALES
Ce travail,
effectué sur les réactivités des bases de MANNICH phénoliques vis-à-vis des
composés à hydrogène mobile confirme la labilité de la liaison carbone-azote et
la formation de nouvelles liaisons carbone-carbone.
C'est ainsi
que les phénols et les aminés aromatiques condensés par voie thermique avec ces
bases ont conduit à différents produits de condensation, la présence d'un noyau
naphtalénique augmentant la réactivité.
En effet,
par condensation thermique ; sans catalyseurs ni solvant.
1°) Par des
bases de MANNICH phénoliques avec les phénols nous avons obtenu les hydroxy-2,2’
diarylméthanes.
Cette voie
d'accès à ces dérivés constitue une méthode générale de préparation qui présente
l'avantage de pouvoir donner les composés: dissymétriques de cette
série.
2°) du
pipéridinométhyl-I naphtol-2 avec les aminés aromatiques, nous a permis de
préparer différentes benzo-7,8 acridines en une seule étape ; cette méthode
permet d'envisager la préparation de benzacridines marquées radioactivement en
position-9 en vue d'une étude biologique.
3°) des
bases avec les amines aromatiques monocycliques de MANNICH phénoliques
monocycliques nous n'avons pas obtenu de résultats satisfaisants. Ces réactions
ne semblent pas aboutir à une méthode préparative.
4°) de la
< FONT FAce=" Symbol">b-naphtylamine
avec les bases de MANNICH des phénols monocycliques nous avons pu isoler dans
d'excellentss conditions, des amino-2 hydroxy-2' benzo-5,6 diarylméthanes,
composés nouveaux qui présentent sous l'action de catalyseurs de déshydratation
une fragilité au niveau du pont méthylène.
Ce nouveau.
type de dégradation suivi d'une recombinaison des radicaux formés nous a permis
de mettre en évidence, par traitement thermique en présence d'iode, que tous ces
amino-2 hydroxy-2’ diarylméthanes conduisent à la dibenzo-I,2,7,8
acridine.
Ces
amino-phénols sont transformés en benzoxanthènes par diazotation. Nous avons
considéré cette réaction comme une extension de la réaction de GRIESS ;
elle constitue une nouvelle voie d'accès aux benzoxanthènes qui par oxydation
par l'oxyde de sélénium en milieu
alcoolique conduisent aux benzoxanthones.
En dehors de
l'étude des bases de MANNICH phénoliques nous avons
préparé de nouvelles bases : les pipéridinobenzyl-2 phénols par action du
benzal-N,N’ bis pipéridine sur les phénols.
Par
ailleurs, nous avons mis au point un nouveau réactif spécifique des acridannes,
l'acide phosphomolybdique.
EN RESUME,
ce travail met essentiellement en lumière :
-
la
préparation de nouveaux composés, les pipéridinobenzyl-2 phénols
-
Une nouvelle
synthèse des benzacridines
-
L'obtention
de nouveaux amino-phénols, les amino-2
hydroxy-2'
benzo-5,6 diarylméthanes.
- Un nouvel
accès aux benzoxanthènes.
Mots clefs : acide / acridine / action / aknin / alcaloïde / aldéhyde / alkylation / amines / aminométhyle / ammoniaque / application / aromatique / base / benzacridine / benzoxanthène / biogenèse / carbone / catalyseur / cétone / composé / condensation / condition / diarylméthane / formol / hydrogène / liaison / mannich / méthode / monocyclique / morphinane / organique / phénol / pipéridine / plante / préparation / pyridinique / réaction / synthèse / thermique / traitement
|
|
visiteurs |
|---|