Mémoire présentée à la
faculté des sciences de l'Université de Paris
pour obtenir le diplôme
d'études supérieures de sciences physiques
par
Jacques Riboulleau
Etude
et généralisation d'une nouvelle réaction des o-hydroxybenzal-3- dioxo-2,4
chromannes
INTRODUCTION
La
grande réactivité du proton en 3 des hydroxy-4 coumarines permet de réaliser de
nombreuses condensations, en particulier avec les aldéhydes, donnant lieu très
généralement à la formation de produits doublés symétriques.
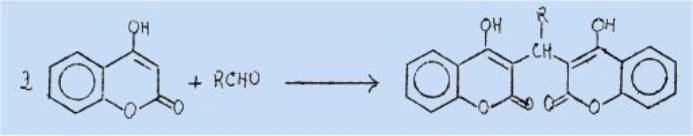
Dans le
cas particulier des aldéhydes aromatiques o-hydroxylés, il est possible
d'isoler, à côté du dérivé doublé normalement attendu, un produit intermédiaire
non saturé correspondant à une condensation équimoléculaire des deux réactifs.

O-hydroxybenzal-3 dioxo-2,4
chromanne.
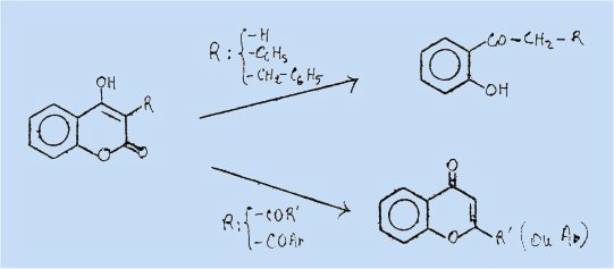
Il était
intéressant d'appliquer à de telles molécules le procédé d'hydrolyse en milieu
acide qui permit récemment à DESCHAMPS-VALLET de transformer les aryl-3 et
arylméthyl-3 hydroxy-4 coumarines en cétones o-hydroxylées correspondantes, par
ouverture de la lactone, puis décarboxylation de l'acide a de la cétone juxtanucléaire, analogue à
la transposition de FEIST.
Ces
résultats sont résumés dans le schéma ci-après :
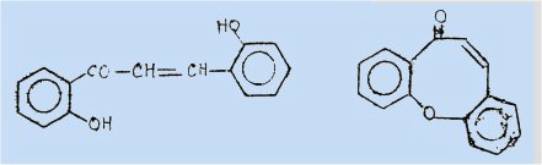
Si l'on considère ces
molécules comme des hydroxy-4 coumarines monosubstituées en 3, le problème se
posait de savoir ce que donneraient, dans des conditions analogues, les
o-hydroxybenzal-3 dioxo-2,4 chromannes, dérivés disubstitués dicétoniques.
Leur
scission en milieu acide aurait pu conduire à des composés du type
suivant :
L’expérience a montré un
résultat tout différent de celui attendu ; la lactone ne s'est pas ouverte, et
le corps obtenu a été identifié, avec de nombreuses preuves irréfutables, à une
(benzopyrano-2',3')-4,3 coumarine (ou 5H, -6H, [1] benzopyrano(3,2-c) [1]
benzopyranone-6) pour laquelle le nom "homocoumestanne" est proposé.
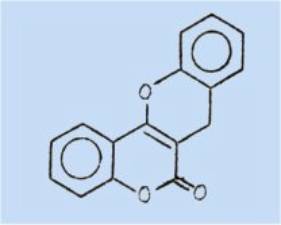
L'étude de cette réaction a
fait l'objet du présent travail. De nombreux essais, tant de conditions expérimentales
que d'introduction de divers substituants, nous ont permis d'entrevoir un
mécanisme pour cette réaction, et de généraliser celle-ci à la série coumarine.
Il a été possible en outre de retendre à d'autres séries apparentées.
L'exposé
de nos recherches comprend trois chapitres.
CHAPITRE
I : cyclisation de divers o-hydroxybonzal-3 dioxo-2,4 chromannes. Obtention
d'homocoumestannes substitués.
CHAPITRE
II : essais d'extension à la série a-pyrone. Nouvel aspect de la réaction.
CHAPITRE
III : extension à 1'isochromannedione-1,4
CONCLUSION
Notre
travail avait pour but l'étude et la généralisation du passage de
l'o-hydroxybenzal-3 dioxo-2,4 chromanne en homocoumestanne, nom proposé pour le
squelette 5H, 6H [l] benzopyrano (3,2-c) [l] benzopyranone-6.
Dans un
premier chapitre, nous avons effectivement préparé plusieurs composés de cette
série, dont un homologue structural du coumestrol, en partant de
benzalcoumarines diversement substituées ; celles-ci ont été obtenues à partir
des hydroxy-4 et dihydroxy-4,7 coumarines, condensées avec les aldéhydes
salicylique, résorcylique, et l'o-vanilline.
L'étude
des conditions expérimentales permet d’envisager qu'il s'effectue une réduction
du chromanne de départ, accompagnée ou suivie d'une cyclodéshydratation. Ce
serait le mélange éthanol/acide chlorhydrique qui jouerait le rôle d'agent
réducteur.
Le
deuxième chapitre décrit nos essais d’extension à la série a-pyronique. Si les benzals d'a-pyrones se sont réellement formées,
avec de bons rendements, en revanche les produits de duplications -toujours
présents dans la série homologue benzopyronique- n'ont jamais été isolés.
L'échec
des essais de cyclisation des o-hydroxybenzal-5 dioxo-2,4 dihydropyrannes
(méthyl-6 et phényl-6) nous a néanmoins permis d’entrevoir un mécanisme nouveau
pour la réaction qui nous préoccupe. L'étape intermédiaire pourrait être, en
réalité, le dérivé de duplication lui-même, possédant déjà le motif
"homocoumestanne" ; il subirait une coupure hydrogénolytique ; cette
hypothèse a été vérifiée dans deux cas.
La
(benzopyrano-2’,5')-4,3 méthyl-6 a-pyrone a été synthétisée en deux étapes, par une voie indirecte
faisant intervenir une hydrogénation catalytique.
Dans une
troisième partie, nous nous sommes adressé à une molécule non énolisée en
position 4, l'isochromannedione-1,4 sur laquelle la condensation de l'aldéhyde
salicylique n'avait jamais été tentée. Seul le produit de crotonisation se
forme. Placé dans les conditions habituelles, il s'est transformé en un
squelette isomère de l'homocoumestanne, qu'aucune méthode, semble-t-il, n'avait
permis de préparer jusqu'ici. La preuve absolue de sa structure est apportée
par l'identité de son produit d'oxydation avec le squelette de la
distémonanthine, synthétisé par une méthode indépendante.
En
conclusion, deux mécanismes restent possibles pour cette réaction ; soit la cyclodéshydratation
réductrice du dérivé o-hydroxybenzylidénique, soit l'hydrogénolyse du produit
de duplication.
Si le
premier semble seul valable,.avec 1'isochromannedione-1,4, les deux peuvent se
concevoir dans la série coumarinique.
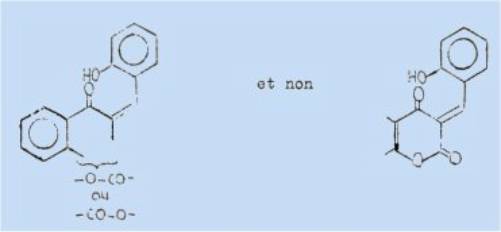
En
outre, l'échec de la réaction dans le cas des méthyl-6 et phényl-6 hydroxy-4 a-pyrones permet de supposer que
l'enchaînement caractéristique nécessaire est le suivant :
Mots clefs : aldéhyde / benzopyrane / benzopyranone /
cétone / chromanne / condensation / condition / coumarine / cyclisation / hydropyranne / distémonanthine /
duplication / essai / étude / homocoumestanne / hydroxybenzal / isochromannedione / lactone / mécanisme /
pyrone / réaction / riboulleau / maitte