Thèse présentée à la faculté des sciences de l’Université de Paris
pour obtenir le grade de Docteur de l’Université
par
Odette ROUSSEL
SYNTHESE DE NOUVELLES SUBSTANCE DANS LES FAMILLES DU DIAZO-2,10 ANTHRACENE ET DE g-CARBOLINE
soutenue en 1965
devant la commission d’examen :
R. Quelet, président
J. Amiel, C. Mentzer, examinateurs
INTRODUCTION
Il a été montré au cours de ces dernières années que de nombreuses substances hétérocycliques ayant plusieurs atomes d’azote sont cancérogènes.
Nous pouvons citer notamment le cas des benzopyrido-carbazoles étudiés dans notre laboratoire et dont certains représentants tels que le benzo(5-6)pyrido [3’,2’:1,2]carbazole (l) et le benzo(5-6)pyrido[2’,3’:1,2] carbazole (Il) possèdent un pouvoir cancérogène extrêmement élevé par comparaison avec celui du benzo(a)pyrène, considéré comme l’un des sarcomogènes les plus puissants.
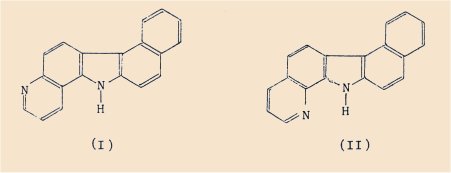
Ainsi, pour le composé (l), l’indice de sarcome d’après Iball est égal à 100 et pour le composé (Il) cet indice est de 64 [4,5], tandis que pour le benzo(a)pyrène il est égal à 71.
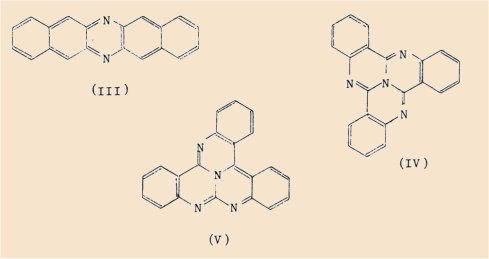
De même que ces benzopyrido-carbazoles, nous pouvons citer, comme renfermant deux atomes d’azote, la dinaphtazine (lll) expérimentée par Hackmann.
La tricycloquinazoline (IV) et ses dérivés qui possèdent quatre atomes d’azote dans leur squelette, ont été étudiés en Angleterre par Partridge et Baldwin.
L’originalité et l’intérêt de toutes ces substances cancérogènes nouvelles consiste dans le fait que leur activité biologique varie dans des proportions considérables, selon les positions relatives qu’occupent les hétéroatomes d’azote les uns par rapport aux autres dans la molécule.
Alors que les corps I et II sont fortement sarcomogènes, leurs analogues structuraux tels que la dibenzo(3,4-7,8)b-carboline (VI) et le benzo-1,2 pyrido[2’,3’:5,6] carbazole (VIbis) ont été trouvés totalement inactifs.
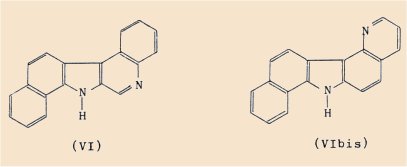
De même dans la série de la tricycloquinazoline, le passage de ce dernier corps (IV) au tétra-azanaphto-naphtacène (V), permet de constater une forte diminution du pouvoir cancérogène.
Récemment, Buu-Hoï a tenté d’expliquer ce phénomène en supposant que ce type de composés cancérogènes polyazotés agissait sur certaines protéines clefs de la cellule par fixation polycentrique mettant en jeu non seulement des zones de haute densité électronique (comme on l’admet dans la théorie électronique simple) mais également les hétéroatomes eux-mêmes.
Ces considérations nous ont amené à établir un programme de recherches relatif à des molécules polycycliques cancérogènes caractérisées par la présence de plusieurs hétéroatomes d’azote dans leur squelette.
Une partie de ce programme, exposée dans la présente thèse, consiste à étudier la synthèse de composés polycycliques dérivés de deux squelettes bi-azotés:
- le diaza-2,10 anthracène (VII)
et
- la g-carboline (VIII)
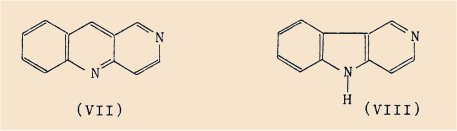
Ces deux noyaux, ainsi que leurs dérivés, n’ont été jusqu’à maintenant que très sommairement étudiés.
De plus, les voies d’accès à ces substances sont peu nombreuses et parfois assez compliquées.
Ainsi le diaza-2,10 anthracène n’a été synthétisé qu’assez récemment par Goscia et Diekermann au moyen d’une technique complexe en six stades successifs et aucun homologue supérieur n’a été signalé.
En ce qui concerne la g-carboline elle-même, bien qu’elle ait été préparée par Robinson en 1924 à partir de la chloro-2 pyridine selon une méthode également laborieuse, celle-ci n’a pas été généralisée aux homologues supérieurs de cet hétérocycle.
II convient toutefois de noter que la présence du 11 H-quinolo[4,3-b]indole (IX) a été prouvée comme existant dans la dégradation alcaline du .jaune Ciba et que quelques dérivés de colorants usuels (le jaune U de Hoechst notamment) sont considérés comme possédant le squelette du diaza-2,10 anthracène dans leur molécule.

De plus, ainsi que l’ont montré les résultats de recherches biologiques sur les molécules polycycliques, l’activité cancérogène locale n’apparaît, à de très rares exceptions près, que lorsque la molécule possède plus de trois cycles.
On sait également que dans le cas particulier des dérivés de l’acridine et du carbazole, le pouvoir oncogène décroît rapidement ou même disparaît lorsque les molécules comportent plus de cinq cycles.
Ces considérations nous ont incité à délimiter le présent travail à l’étude de dérivés tétracycliques et pentacycliques du diaza-2,10 anthracène (VIl) et de la g-carboline (VIII).
A - Série du diaza-2,10 anthracène.
Pour préparer les diaza-2,10 anthracènes diversement substitués nous avons utilisé la réaction de Pfitzinger préconisée en 1924 par Clemo et Perkin.
Nous avons généralisé cette technique en l’appliquant non seulement à diverses céto-4 tétrahydro-1,2,3,4 quinoléines (X,XI,XII), mais également en utilisant des homologues méthylés et diméthylés de l’isatine.
En outre, nous avons simplifié le processus opératoire permettant d’isoler la dihydro-2,3 quinolone-4 (X; R=H).
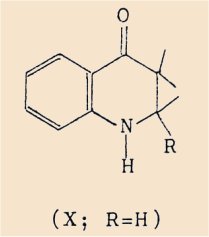
Les dérivés de cette dernière que nous avons également utilisés sont :
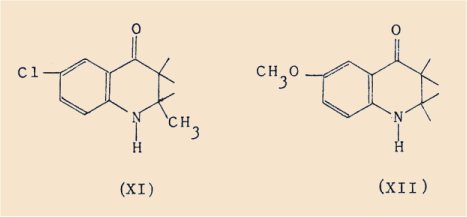
- la méthyl-2 céto-4 chloro-6 tétrahydro-1,2,3,4 quinoléine (XI)
- la céto-4 méthoxy-6 tétrahydro-1,2,3,4 quinoléine (XII).
La condensation de (X; R=H) avec l’isatine avait permis à Clemo et Perkin d’isoler selon le schéma suivant :
a)l’acide dihydro-5,6 quinolo[3,2-c] quinoléine carboxylique-7 (XIII) qui, par décarboxylation thermique, a donné :
b) la dihydro-5,6 quinolo[3,2-c]quinoléine (XVIII); le passage sur charbon palladié de ce dernier composé a fourni :
c) la quinolo[3,2-c]quinoléine (XX).
La méthyl-5 isatine condensée selon le même processus avec (X; R=H) nous a conduit successivement à :
a) l’acide dihydro-5,6 quinolo[3,2-c]méthyl-9 quinoléine carboxylique-7 (XIV),
b) la dihydro-5,6 quinolo[3,2-c] méthyl-9 quinoléine (XIX),
c) la quinolo[3,2-c]méthyl-9 quinoléine (XXI).
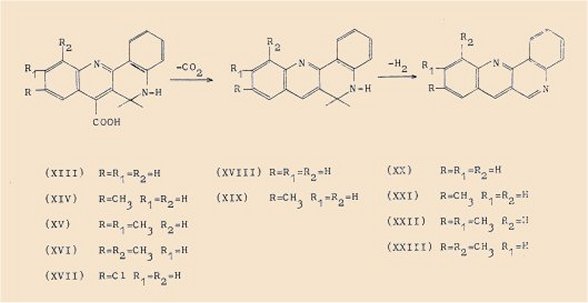
La diméthyl 5,6 isatine a fourni :
a) l’acide dihydro-5,6 quinolo[3,2-c]diméthyl-9,10 quinoléine carboxylique-7 (XV),
b) la quinolo[3,2-c]diméthyl-9,10 quinoléine (XXIl).
De même avec la diméthyl-5,7 isatine, nous avons obtenu :
a) l’acide dihydro-5,6 quinolo[3,2-c]diméthyl-9,11 quinoléine carboxylique-7 (XVI),
b) la quinolo[3,2-c]diméthyl-9,11 quinoléine (XXIIl).
Ce faisant nous avons pu montrer que la décarboxylation des acides (XV) et (XVI) effectuée à haute température s’accompagne d’une déshydrogénation du dérivé dihydrogéné-5,6 qui devrait se former intermédiairement.
Enfin la chloro-5 isatine nous a permis d’isoler l’acide dihydro-5,6 quinolo[3,2-c]chloro-9 quinoléine carboxylique-7 (XVII) mais la décarboxylation a conduit à une résinification totale du produit.
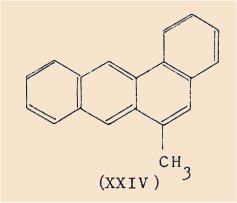
Le fait que dans la série du benzo(a)anthracène ainsi que dans la série analogue de la benzo(c)acridine, la présence d’un substituant méthylé sur la zone mésophénanthrénique, loin d’affaiblir le pouvoir cancérogène semble le renforcer [cas du méthyl-6 benzo(a)anthracène (XXIV)], nous a amené à synthétiser des quinolo[3,2-c]quinoléines portant également un radical méthyle sur le sommet 6.
Etant donné que la méthyl-2 céto-4 tétrahydro-1,2,3,4 quinoléine (X; R=CH ) est peu accessible, nous avons utilisé une voie détournée pour accéder à ces quinolo-quinoléines désirées.
Notre matière première a été la méthyl-2 céto-4 chloro-6 tétrahydro-1,2,3,4 quinoléine (XI) que nous avons obtenue en condensant la para chloroaniline sur l’acide crotonique et en cyclisant l’acide obtenu par une méthode analogue à celle utilisée pour (X; R=H).
La réaction de Pfitzinger appliquée à (XI) d’une part et à l’isatine d’autre part nous a donné :
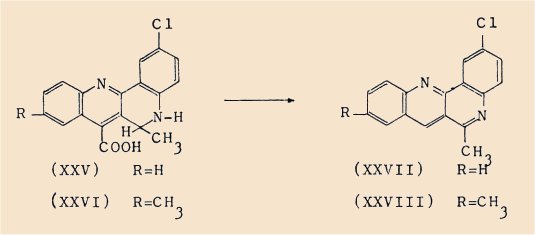
a) l’acide chloro-2 dihydro-5,6 méthyl-6 quinolo[3,2-c] quinoléine carboxylique-7 (XXV) qui, par décarboxylation thermique et déshydrogénation spontanée, nous a conduit à :
b) la chloro-2 méthyl-6 quinolo[3,2-c]quinoléine (XXVII)
De même la méthyl-5 isatine a fourni :
a) l’acide chloro-2 dihydro-5,6 diméthyl-6,9 quinolo[3,2-c] quinoléine carboxyliquo-7 (XXVI),
b) la chloro-2 diméthyl-6,9 quinolo[3,2-c]quinoléine (XXVIIl).
Ces dérivés chlorés peuvent être aisément déshalogénés par action du Nickel Raney en milieu isopropanolique.
Cette deshalogénation, qui avait été expérimentée sur certains acides aryl carboxyliques, n’avait pas, à notre connaissance, encore été appliquée à la série des chloroquinoléines.
Ainsi nous avons pu isoler :
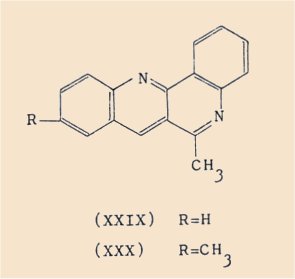
a) la méthyl-6 quinolo[3,2-c]quinoléine (XXIX),
b) la diméthyl-6,9 quinolo[3,2-c]quinoléine (XXX).
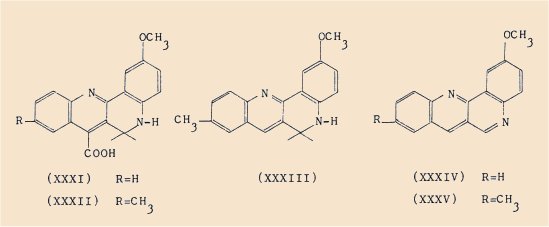
Enfin la céto-4 méthoxy-6 tétrahydro-1,2,3,4 quinoléine (XII) a donné successivement, par réaction de Pfitzinger avec l’isatine :
a) l’acide méthoxy-2 dihydro-5,6 quinolo[3,2-c]quinoléine carboxylique-7 (XXXI) qui, par décarboxylation et déshydrogénation spontanée au cours de cette décarboxylation, a conduit à :
b) la méthoxy-2 quinolo[3,2-c]quinoléine (XXXIV).
Avec la méthyl-5 isatine nous avons isolé :
a) l’acide méthoxy-2 dihydro-5,6 méthyl-9 quinolo[3,2-c] quinoléine carboxylique-7 (XXXII),
b) la méthoxy-2 dihydro-5,6 méthyl-9 quinolo[3,2-c]quinoléine (XXXIIl),
B - Série de la g-carboline.
Les dérivés de la benzo(a) g-carboline peuvent être aisément préparés par indolisation des arylhydrazones des céto-4 tétrahydro-1,2,3,4 quinoléines (X; R=H, XI, XII), que celles-ci soient sous leur forme libre ou N-tosylée.
Dans le cas des cétones N-tosylées, la cyclisation par les acides acétique et sulfurique entraîne automatiquement la détosylation. Mais dans un cas comme dans l’autre l’indolisation est toujours accompagnée d’une déshydrogénation de l’indole dihydrogéné intermédiairement formé.
La céto-4 tétrahydro-1,2,3,4 quinoléine (X; R=H) condensée successivement avec la phénylhydrazine, la para-tolylhydrazine, la diméthyl-2,3 phénylhydrazine et la diméthyl-3,4 phénylhydrazine nous a permis de préparer :
a) le 11H-quinolo[4,3-b]indole (XXXVI),
b) le méthyl-8 11H-quinolo[4,3-b]indole (XXXVII),
c) le diméthyl-9,10 11H-quinolo[4,3-b]indole (XXXVIII),
d) le diméthyl-8,9 11H-quinolo[4,3-b]indole (XXXIX),
qui sont quatre analogues azotés du benzo(a)carbazole.

De même, les a- et b-naphtylhydrazines et la quinoléyl-6 hydrazine nous ont permis de préparer deux dibenzo g-carbolines et une benzo-pyrido g-carboline qui sont des isostères non seulement des dibenzo[a,g] et dibenzo[a,i]carbazoles cancérogènes, mais également des benzopyridocarbazoles encore plus actifs de ce point de vue.
Voici ces composés :
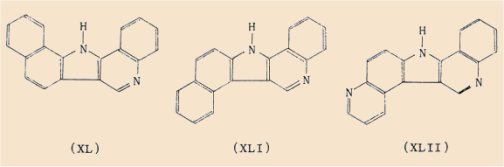
a) le 13H-benzo(g)quinolo[4,3-b]indole (XL),
b) le 13H-benzo(e)quinolo[4,3-b]indole (XLI),
c) le 13H-pyrido[3,2-e]quinolo[4,3-b]indole (XLII),
En parallèle avec ce que nous avions réalisé dans la série du diaza-2,10 anthracène, nous avons cyclisé quatre hydrazones de la méthyl-2 céto-4 chloro-6 tétrahydro-1,2,3,4 quinoléine (XI).
Les g-carbolines chlorées suivantes ont été isolées :
- le chloro-2 méthyl-6 11H-quinolo[4,3-b]indole (XLIIl),
- le chloro-2 diméthyl-6,8 11H-quinolo[4,3-b]indole (XLIV),
- le chloro-2 méthyl-6 13H-benzo(g)quinolo[4,3-b]indole (XLV),
- le chloro-2 méthyl-6 13H-benzo(e)quinolo[4,3-b]indole (XLVl).
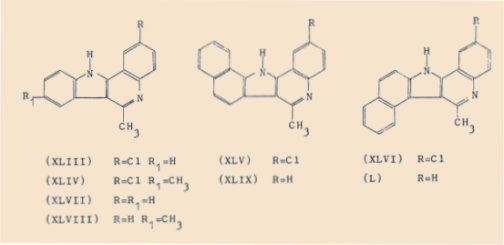
La déshalogénation de ces substances a fourni aisément :
- le méthyl-6 11H-quinolo[4,3-b]indole (XLVIl),
- le diméthyl-6,8 11H-quinolo[4,3-b]indole (XLVIII),
- le méthyl-6 13H-benzo(g)quinolo[4,3-b]indole (XLIX),
- le méthyl-6 13H-benzo(e)quinolo[4,3-b]indole (L).
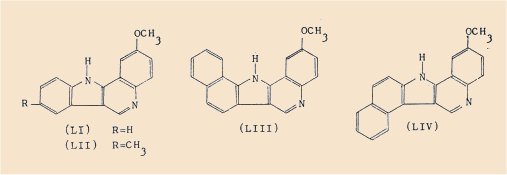
Enfin la céto-4 méthoxy-6 tétrahydro-1,2,3,4 quinoléine (XII) a conduit, selon le même processus, aux :
- méthoxy-2 11H-quinolo[4,3-b]indole (Ll),
- méthoxy-2 méthyl-8 11 H-quinolo[4 ,3-bjindole (LII),
- méthoxy-2 1 3H-benzo(g)quinolo[4 ,3-b]indole (LIII),
- méthoxy-2 13H-benzo(e)quinolo[4,3-b]indole (LIV).
C - Pyrido g-carbolines.
On accède à de tels composés en cyclisant les arylhydrazones de la N-benzyl pipéridone-4 (LV), ce qui forme intermédiairement des dérivés N-benzylés tétrahydrogénés lesquels subissent une débenzylation simultanée à la déshydrogénation par le charbon palladié, comme nous l’avons montré récemment.
Ainsi la quinoléyl-5 hydrazine nous a permis de préparer le pyridologue suivant de la g-carboline ;
- la pyrido[2’,3’-i] g-carboline (LVII) dont nous avons d’ailleurs isolé le dérivé N-benzylé tétrahydrogéné (LVI),
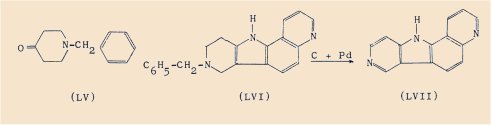
Le but poursuivi était d’effectuer une comparaison chimique et biochimique avec les hétérocycles mentionnés plus haut.
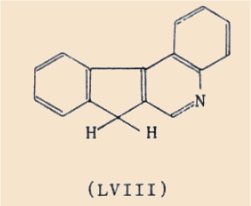
Enfin dans un tout autre ordre d’idées, nous avons essayé de cycliser des chalcones issues de (X) afin d’obtenir des isostères azotés du benzo(c)fluorène (LVIIl), mais jusqu’à maintenant ces tentatives ont échoué.
Avant de terminer nous signalerons que les dérivés du diaza-2,10 anthracène sont en général des composés fondant relativement bas; tous les dérivés de la g-carboline fondent très haut, certains points de fusion dépassent 400°.
De plus ces derniers corps brûlent très mal, ce qui explique le fait que plusieurs d’entre eux ne donnent que de très mauvaises analyses de carbone.
Dans ces cas, les structures en question ont été vérifiées par la spectrométrie de masse.
Le comportement de ces substances est tout à fait normal à ce point de vue, et confirme la stabilité très grande de ces noyaux : pics moléculaires très intenses, peu de fragmentation, présence de pics à charges multiples.
L’étude dans l’ultraviolet de nos substances a également été réalisée et enfin les propriétés biologiques des g-carbolines et diaza-2,10 anthracènes que nous avons préparés seront décrites ultérieurement.
Nous ferons notre exposé selon le plan suivant :
1ère partie - Dérivés de la céto-4 tétrahydro-1,2,3,4 quinoléine (X; R=H).
2ème partie - Dérivés de la méthyl-2 céto-4 chloro-6 tétrahydro-1,2,3,4 quinoléine (XI).
3ème partie - Dérivés de la céto-4 méthoxy-6 tétrahydro-1,2,3,4 quinoléine (XII).
4ème partie - Etude physico-chimique.
5ème partie - Conclusion.
6ème partie - Références bibliographiques.
Nous nous sommes efforcés, dans ce mémoire, d’employer, dans la mesure du possible, une nomenclature conforme aux règles de l’Union Internationale de Chimie Pure et Appliquée, qui sont énoncées dans le fascicule n°10 du Bulletin de la Société Chimique de France, Octobre 1958.
CONCLUSION
Après l’exposé détaillé des aspects théoriques et pratiques de cette thèse, il convient de dégager certains points essentiels.
1) Diverses considérations ont présidé à notre choix de synthèses de substances appartenant aux familles du diaza-2,10 anthracène et de la g-carboline:
a) importance, en cancérogenèse chimique, de composés hétéro-cycliques contenant deux atomes d’azote dans leur molécule et, en particulier, de composés tétra et pentacycliques.
b) intérêt présenté par la synthèse, le comportement et l’étude de la structure de tels composés.
2) Pour obtenir ces molécules relativement peu étudiées, nous avons préconisé des voies d’accès plus simples et plus rapides que celles déjà décrites, en particulier en ce qui concerne les matières premières.
Nous avons étendu ces synthèses à des homologues méthylés, puis à des benzologues et des pyridologues des squelettes fondamentaux du diaza-2,10 anthracène et de la g-carboline.
3) Dans le cas des diaza-2,10 anthracènes (ou quinoloquinoléines), nous avons pu, en particulier :
a) préciser la durée du temps de chauffage lors de la réaction de Pfitzinger en fonction des substituants fixés sur les réactants en présence (cétones et isatines) et étudier les divers acides cinchoniniques obtenus.
b) montrer que la décarboxylation de ces acides n’était pas obligatoirement accompagnée de l’obtention directe de la. quinoloquinoléine cherchée.
Dans certains cas, les dérivés hydrogénés de ces bases ont pu être isolés (dans le cas des quinoloquinoléines halogénées la déshydrogénation a toujours été spontanée).
c) appliquer à nos quinoloquinoléines une méthode pratique et efficace de deshalogénation encore inédite vis-à-vis de telles molécules.
Cette technique nous a permis d’isoler une série de corps difficiles à atteindre par une autre voie.
d) observer que le point de fusion de ces quinoloquinoléines était relativement bas et inférieur à celui de leurs dérivés hydrogénés.
4) Dans le cas des g-carbolines, nous pouvons :
a) signaler que nos cétones ont formé aisément des hydrazones mais que ces dernières n’ont pas toujours été isolables ; de plus, dans certains cas elles se sont cyclisées spontanément.
b) affirmer que la cyclisation des hydrazones s’est toujours accompagnée d’une déshydrogénation; notons que dans le cas particulier des cétones de départ N-tosylées, il y a toujours eu cyclisation, détosylation et déshydrogénation simultanées.
c) confirmer que la déshalogénation des chloroquinolo-indoles se fait d’une manière aussi aisée que dans le cas des quinoloquinoléines.
d) noter le point de fusion très élevé de ces benzologues et pyridologues des g-carbolines, et de plus, supérieur à celui des benzocarbazoles correspondants.
5) Nous avons utilisé le spectromètre de masse pour déterminer les pics moléculaires, vérifier les structures et étudier les fragmentations possibles de nos substances dans ce cas.
Une comparaison avec des composés de structure générale analogue a été ébauchée dans le domaine de la spectroscopie ultraviolette.
Un certain nombre de substances décrites, font actuellement l’objet d’essais biologiques en vue de déterminer leur activité cancérogène.
6) Au cours de ce travail nous avons isolé 44 substances qui, à notre connaissance, n’étaient pas encore décrites dans la littérature.
Certaines ont été caractérisées par leur picrate.
MOTS CLEFS : acide / activité / analogue / anthracène / benzo / cancérogène / carbazole / carboline / carboxylique / cétone / chloro / cyclisation / dérivé / deshalogénation / déshydrogénation / diaza / dihydro / diméthyl / hétéroatome / homologue / hydrazone / indole / isatine / méthyle / molécule / phénylhydrazine / pyrido / quinoléine / quinoloquinoléine / réaction / structure / synthèse / tétrahydrogéne