Thèse présentée à la faculté des sciences de l’Université de Paris
pour obtenir le grade de Docteur ès sciences naturelles
par
Joseph PARELLO
ALCALOÏDES DUPHYLLANTHUS DISCOÏDESMUELL. ARG.
Isolement et détermination des structures
soutenue en mai 1966
AVANT-PROPOS
La chimie des alcaloïdes a constitué, pendant plus d'un siècle, une "branche très attrayante de l’étude des substances naturelles d'origine végétale.
Depuis plus de trente ans, le professeur M-M. JANOT et le docteur R. GOUTAREL se sont spécialisés, au laboratoire de Pharmacie Galénique de la Faculté de Pharmacie de Paris, dans l'étude des alcaloïdes de diverses familles végétales, et plus particulièrement, des Apocynacées.
A côté de cette importante famille botanique, M-M. JANOT et R. GOUTAREL ont entrepris des recherches sur de nombreuses plantes africaines à alcaloïdes et c'est ainsi qu’ils n’ont proposé comme sujet de thèse l'étude chimique du Phyllantus discoïdes Muell. Arg. appartenant à la famille des Euphorbiacees
En 1957, M-M. JANOT et R. GOUTAREL avaient extrait des écorces de racines du Phyllantus discoïdes d’origine congolaise un principe basique, dénommé phyIIochrysine, qui possédait une activité pharmacodynamique proche de celle de la strychnine.
L'objet de cette thèse est la détermination de la structure de la phyllochrysine et des alcaloïdes mineurs contenus dans les écorces de racine du Phyllantus discoïdes Muell. Arg.
Avant d’aborder cet exposé, je tiens à remercier :
Mr J. RENARD, Directeur des laboratoires Omnium Chimique, à Bruxelles, ainsi que Mr J. MAINIL, Directeur Scientifique, qui m'ont procuré les écorces de racine de Phyllantus discoïdes,
Mr le docteur L. LABLER, de l'Institut de Chimie des Substances Naturelles de Prague, qui, au cours d’un séjour dans notre laboratoire de l'I.C.S.N., m'a prodigué de si précieux conseils,
Mr le docteur S. MUNAVALLI qui m’a aidé au cours de l'établissement de la structure de la phyllantine,
Mr J-P. ALAZARD pour son assistance technique,
Mme C.PASCARD-BILLY, du laboratoire de cristallochimie du C.N.R.S. à la Sorbonne, de m'avoir aidé au cours de ce travail par l'analyse cristallographique de l’iodométhylate de phyllochrysine à l'aide des rayons X,
Mr le docteur A. MELERA, de la société Varian à Zurich, de n’avoir initié à la méthode de double résonance en RMN,
MM. H-E. AUDIER, P,LONGEVIALLE, W. VETTER et B. DASS pour des discussions relatives à l'interprétation des spectres de masse de la sécurinine et de ses dérivés.
INTRODUCTION
De 1962 à 1965, l'étude chimique des constituants de différentes espèces végétales de la famille des Euphorbiacées (Securinega suffruticosa, Securinega virosa et Phyllantus discoïdes) a conduit à la découverte d’un type nouveau d’alcaloïdes dont le chef de file est la sécurinine.
La sécurinine avait été isolée en 1956 des feuilles du Securinega suffruticosa par MURAVJEVA et BANKOVSKII en U.R.S.S. : à l’époque seuIe la formule brute C13H15NO2 et quelques éléments structuraux avaient été avancés : présence d'une g-lactone, de deux doubles liaisons conjuguées, absence de tout groupement méthyle et d'hydrogène mobile du type NH ou OH.
En 1957, JANOT et coll. avaient décrit un nouvel alcaloïde retiré des écorces de racine du Phyllantus discoïdes Muell. Arg. (Congo ex-belge) qu'ils avaient nommé phyllochrysine ; un examen plus approfondi a montré qu'il s'agissait d’un syncristallisat de deux bases isomères dont l'une était identique à la sécurinine, le nom de phyllochrysine a été conservé pour la seconde.
A. STRUCTURE PLANE DE LA SÉCURININE
L'étude de la structure de la sécurinine a été abordée, à partir de 1962, simultanément par trois groupes de chercheurs japonais :
1) En juin 1962, SAITO et coll. ont proposé pour la sécurinine, C13H15N02, F 142-143°, [a]sub>D - 1042° (EtOH), la formule plane 1.

Le spectre UV (lmax = 256 mm, loge = 4,27, éthanol) et le spectre IR (vmax 1840, 1760 cm-1, lactone et 1640 cm-1, double liaison) indiquent la présence de l'enchaînement buténolide conjugué avec une double liaison :
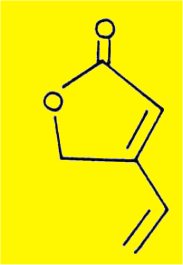
Le spectre de RMN de la sécurinine en solution dans CDCl3 rend compte aussi de la présence dans la molécule de sécurinine de cet enchaînement ; les trois protons éthyléniques correspondants apparaissent de façon évidente sur le spectre :
- un singulet à 5,56 ppm correspondant au proton 4,
- entre 6,3 et 6,8 deux protons sous forme de la partie AB d'un système ABX correspondant aux protons éthyléniques 6 et 7 couplés avec un proton allylique en position 8.
Une preuve décisive pour l'établissement de la structure est apportée par l'obtention au cours de l'hydrogénation catalytique de la sécurinine d'un produit "hexahydrogéné". C13H21NO2, F 184°, [a]D+ 3° (EtOH) présentant sur le spectre IR une bande à 3380 cm-1, caractéristique d'une fonction alcool tertiaire et une bande à 1630 cm-1, correspondant à une fonction amide tertiaire; SAITO et coll. ont attribué à ce dérivé la structure plane 2.
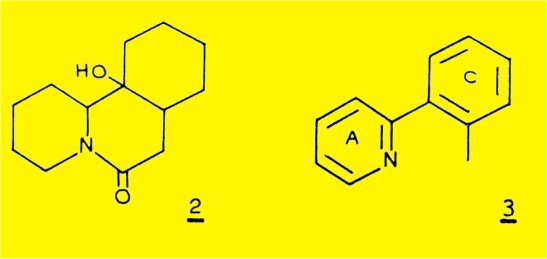
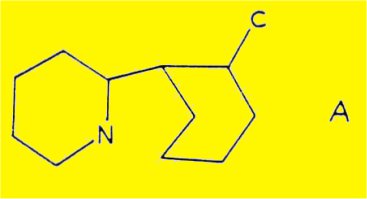
La deshydrogénation catalytique du dérivé 2 conduit à l'o-tolyl-2 pyridine (formule 3) , identifiée par comparaison avec un échantillon synthétique ; l'obtention de ce dérivé aromatique permet d'écrire la structure partielle A, comportant 12 des 13 atomes de la molécule de sécurinine.
La formation du dérivé "hexahydrogéné" 2 peut être expliquée par la possibilité d'une hydrogénolyse de type allylique de la liaison C8-N conduisant à l'apparition d'une aminé secondaire ; celle-ci est susceptible d'attaquer la fonction lactone pour donner une fonction amide et une fonction alcool ; la participation d'une amine secondaire au mécanisme de formation du dérivé 2 est établie par l'obtention du produit N-acétylé 4 après acétylation du produit brut d'hydrogénation.
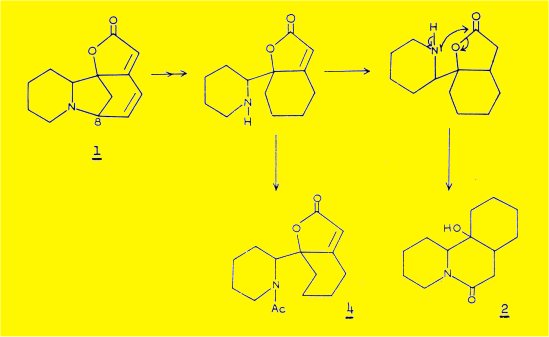
2) En juillet 1962, I. SADOTA et coll. ont proposé la même structure plane 1 pour la sécurinine, isolée du Securinega suffruticosa ; leur étude chimique, quoique différente de celle des auteurs précédents, met aussi en évidence la fragilité de la liaison C8-N dans les conditions d'hydrogénolyse.
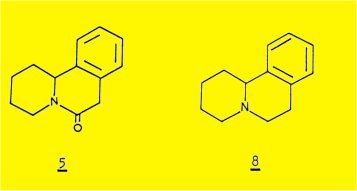
Le traitement de la sécurinine en solution dans l'éthanol par le zinc et l'acide sulfurique conduit, avec un très bon rendement, à un dérivé inattendu, C13H15NO, correspondant très probablement à la structure 5.
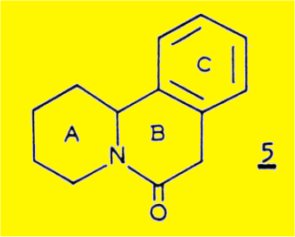
SADOTA et coll. expliquent la formation de ce dérivé par la possibilité d'une hydrogénolyse de la liaison C8-N de la sécurinine causée par un transfert électronique de l'atome de zinc sur l'atome d'azote positif par l'intermédiaire du système buténolide conjugué :
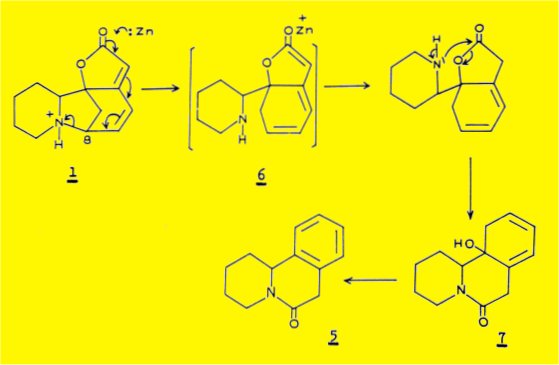
L'amine secondaire 6 formée intermédiairement est susceptible d'attaquer la lactone pour conduire au lactame-carbinol 7 ; la deshydratation de cet alcool tertiaire en milieu acide sulfurique conduit finalement au dérivé 5.
SADOTA et coll. n'ont cependant pas pu établir de façon certaine la structure du dérivé 5 : la structure cyclique du type benzo (a) quinolizine n'a pas été démontrée ; seul l'enchaînement benzénique ortho disubstitué a été établi de façon certaine par l'obtention d'acide phtalique après oxydation du dérivé 5 par le permenganate de potassium.
3) En juin 1962. T.NAKANO et coll. avaient isolé des feuilles du Securinega virosa un nouvel alcaloïde, nommé virosécurinine. C13H15NO2, F 139-140°, [a]D + 1148° (CHCl3), qui doit être considéré comme l'antipode optique de la sécurinine.
La dégradation de cet alcaloïde par le zinc et l'acide sulfurique conduit, comme dans le cas de la sécurinine, à une amide C13H15NO, dont la structure 5 a été précisée comme suit :
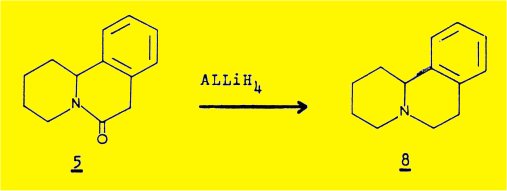
- la réduction par l'hydrure d'aluminium-lithium du dérivé 5 fournit la benzo(a)quinolizidine 8, optiquement active, identifiée par comparaison avec un échantillon racémique obtenu par synthèse .
Les résultats des trois travaux mentionnés ont permis d'attribuer à la sécurinine la formule plane 1.
Les preuves utilisées pour la détermination de cette structure sont basées essentiellement sur l'obtention des dérivés 2 et 5 possédant le squelette benzo (a) quinolizine ; ces dérivés, ayant le même nombre de carbones que le produit initial (sécurinine ou virosécurinine), découlent de l'hydrogénolyse de la liaison Cn-N qui apparaît comme le trait le plus caractéristique de la chimie des alcaloïdes de la série "sécurininine".
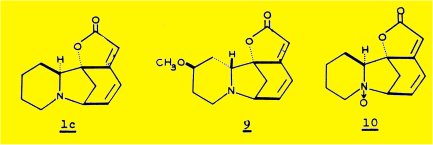
L'extraction des écorces de racine du Phyllantus discoïdes Muell. Arg. nous a permis d'isoler quatre alcaloïdes : la sécurinine 1a, la phyllochrysine 1c, la phyllantine 9 et la phyllantidine 10, les deux premiers étant les constituants majeurs de la plante.
En 1962, nous avions entrepris l'étude de la structure de la sécurinine dont nous avions pu isoler une quantité notable.
Cette étude préliminaire, comprenant l'examen des spectres UV, IR, de masse et de RMN, avait coïncidé avec la parution des résultats des travaux des trois groupes de chercheurs japonais, établissant la structure 1 pour la sécurinine.
L'interprétation détaillée du spectre de RMN de la sécurinine à l'aide de la méthode de double résonance nous avait permis alors d'apporter une preuve supplémentaire à l'exactitude de la structure proposée ; en effet, le spectre de RMN de la sécurinine fait apparaître de façon nette les signaux de neuf protons parmi les quinze de la molécule : protons éthyléniques 4,6 et 7, protons en a de l'azote 8,10a, 10b et 14 et les deux protons 15a et 15b ; les relations de couplage entre ces divers protons ont pu être précisées par l'emploi de la double résonance qui permet d'établir avec certitude l’enchaînement des cycles C et D.
L'étude du spectre de RMN" de la sécurinine apparaît intéressante à deux points de vue :
- la résonance magnétique nucléaire constitue une méthode bien appropriée à l'étude des structures du type "sécurinine".
- d'autre part, la rigidité de la molécule étudiée, comprenant dans son squelette un système bicyclique du type [3.2.1], permet d'établir certaines relations entre les paramètres observés sur le spectre et les caractéristiques structurales.
Nous exposerons ces deux aspects de l'étude de la sécurinine par RMN dans le chapitre II.
Après cette étude, notre intérêt a porté sur la détermination des structures des trois autres alcaloïdes isolés à partir du Phyllantus discoïdes, la phyllochrysine, la phyllantine et la phyllantidine.
Rapidement, l’examen des spectres UV, IR, de masse et de RMN, nous a permis de ranger ces trois alcaloïdes dans la série "sécurinine".
La dégradation par le zinc et l'acide sulfurique, utilisée au cours de l'établissement de la structure de la sécurinine, nous a paru la réaction la mieux appropriée à l'étude d'autres alcaloïdes de structure apparentée ; dans ces conditions, la phyllochrysine 1c conduit à la même lactame 5b que la virosécurinine, énantiomère de la lactame 5a obtenue à partir de la sécurinine ; la réduction par l'hydrure d'aluminium-lithium de ces deux lactames conduit aux deux formes énantiomères 8a et 8b de la benzo (a) quinolizidine.
Les mêmes réactions faites à partir de la phyllantine 9a aboutissent à un produit identifié à la méthoxy-12benzo(a)quinolizÎTine (formule 12a), par comparaison, avec un échantillon racémique de synthèse et détermination de sa configuration absolue.
L'obtention des benzoquinolizidines 5b et 12a prouve la présence, dans les molécules de phyllochrysine et de phyllantine du squelette caractéristique de la sécurinine.
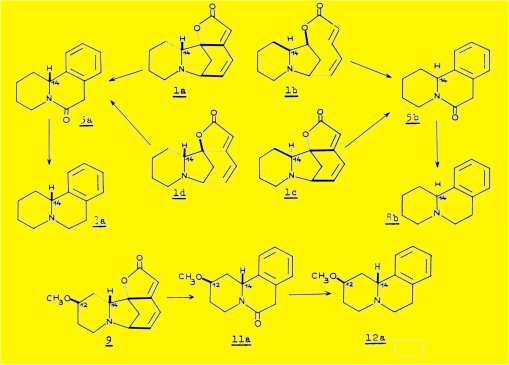
Les molécules de structure plane 2, 5, 8, 11 et12, possèdant le squelette benzo(a)quinolizidine devraient être désignées suivant les règles de la nomenclature chimique utilisées dans le cas de ce système tricyclique :
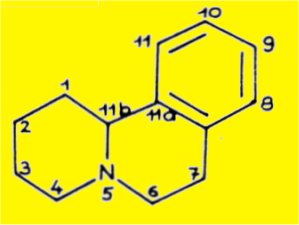
L'observation scrupuleuse des prescriptions de la nomenclature nous oblige à désigner de façon différente les atomes de la molécule de sécurinine et de benzo(a)quinolizidine qui provient de la dégradation de cet alcaloïde ; pour la comodité de l'exposé nous emploierons une numérotation commune pour les deux molécules correspondant à celle de la molécule initiale de sécurinine :
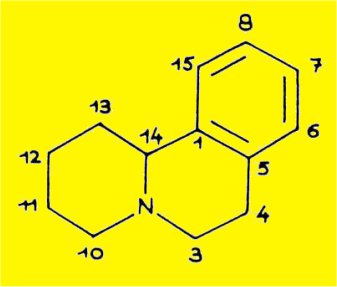
B. CONFIGURATION DE LA SÉCURININE
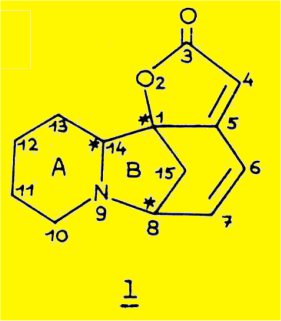
L'examen de la formule plane 1 indique la présence de trois carbones asymétriques, les carbones 1, 8 et 14 ; ceux-ci constituent seulement deux éléments d'asymétrie indépendants ; l'un d'eux est formé par les carbones 1 et 8, têtes de pont du système bicyclique [3.2.l] comprenant les carbones 1, 5, 6, 7, 8, 14, 15 et l'atome d'azote ; l'autre élément d'asymétrie correspond au carbone 14.
La présence de ces deux éléments dans la molécule permet la possibilité de deux sortes d'isomères, ceux pour lesquels l'hydrogène 14 occupe la position exo par rapport au pont méthylénique du système bicyclique [3.2.1] et ceux pour lesquels il occupe la position endo.

La formule 13, dans laquelle l'atome d'azote est remplacé par un atome de carbone, présente par rapport à la formule 1 un carbone asymétrique supplémentaire et une nouvelle possibilité d'isomérie correspondant à la fusion cis et trans des cycles A et B; à la formule 13 correspondent huit isomères possibles.
Dans le cas de la structure azotée 1, la possibilité d'inversion de l'atome d'azote trigonal permet à la molécule d'adopter la conformation la plus stable correspondant à la fusion cis ou trans des cycles A et B ; l'atome d'azote ne doit donc pas être considéré comme un élément d'asymétrie supplémentaire et à la formule 1 correspondent les quatre isomères 1a, 1b, 1c et 1d.
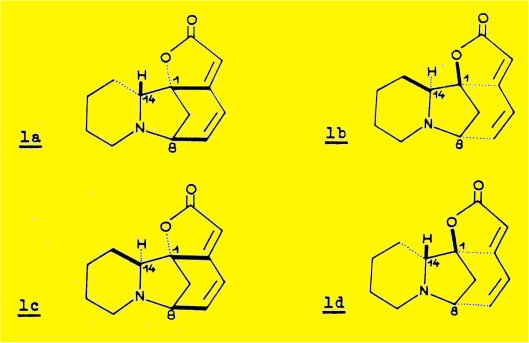
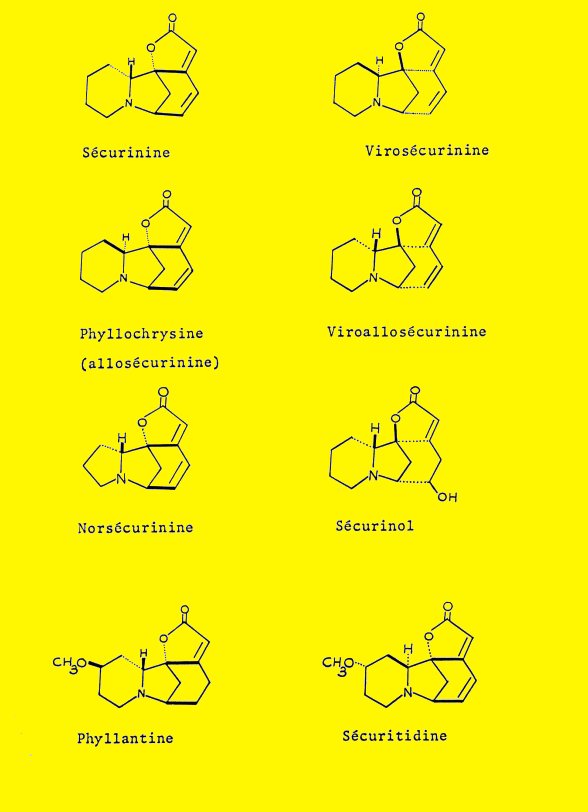
Ces quatre isomères ont été identifiés aux quatre substances naturelles : la sécurinine 1a, et son inverse optique, la virosécurinine 1b, la phyllochrysine (ou allosécurinine) 1c et son inverse optique, la viroallosécurinine 1d.
La détermination de la configuration de la sécurinine a été abordée par différentes méthodes qui doivent être classées en deux catégories : celles établissant la configuration relative des deux éléments d'asymétrie (configuration des carbones 1 et 14, par exemple) et celles conduisant à la configuration absolue de l'un de ces éléments.
1) Configuration relative des carbones asymétriques 1 et 14. (S. SAITO et coll.).
Les lactame-carbinols de formule plane 2 présentent trois carbones asymétriques dont deux, les carbones 1 et 14, conservent la configuration initiale des carbones correspondants de la molécule de sécurinine ; il en est de même pour les amino-alcools de fornule 14, obtenus par réduction de la fonction amide en fonction amine tertiaire par l'hydrure de lithium et d'aluminium.

L'étude de la configuration des carbones 1 et 14 de la sécurinine peut être abordée par celle des amino-alcools 14 dérivant de cet alcaloïde.
Théoriquement, il peut exister huit isomères de formule plane 14 (trois carbones asymétriques), formant quatre groupes distincts de racémiques.
Comme dans le cas de la sécurinine, l'azote n'introduit pas de nouvelle possibilité d'isomérie puisque les fusions cis ou trans des cycles A et B correspondent à deux conformations de la même molécule : l'inversion de la configuration de l'azote permet à la molécule d'adopter la conformation la plus stable.
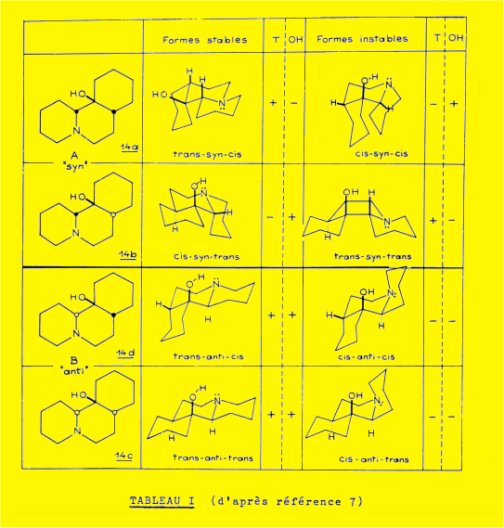
Les différentes formes possibles sont représentées sur le tableau I et elles ont été classées en formes stables et formes instables, par analogie avec l'étude de la stabilité relative des différentes configurations du perhydrophénanthrène (8) ; pour la commodité de l'exposé, nous nous bornons à la description des quatre isomères ayant même configuration absolue pour le carbone 1.
Les alcaloïdes énantiomères 1a et 1b, ayant l'hydrogène 14 en position endo, doivent conduire au groupe A d'amino-alcools, présentant la configuration syn ; les deux autres alcaloïdes 1C et 1d, ayant l'hydrogène 14 en position exo, conduisent au groupe B d'amino-alcools caractérisés par la configuration anti.
Chaque groupe comprend deux amino-alcools épimères sur le carbone 5 ; l'apparition de ce carbone asymétrique au cours de l'hydrogénation laisse prévoir pour chaque alcaloïde, l'existence de deux dérivés "hexahydrogénés" épimères en 5.
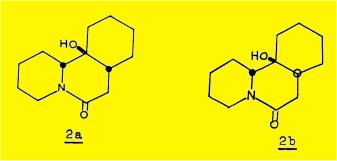
SAITO et coll. ont obtenu à partir de la sécurinine, en variant les conditions de l'hydrogénation (charbon palladié et nickel Raney) l'un et l'autre des deux épimères possibles à partir de cette molécule (2a et 2b).
La stéréochimie des amino-alcools 14 a été étudiée par SAITO et coll. à l'aide des deux critères "infra-rouge suivants :
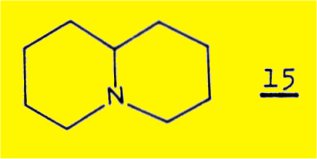
a)- d'après BOHLMANN, la présence de plusieurs bandes d'absorption d'intensité assez forte dans la région 2700-2800 cm-1 est caractéristique de la fusion trans des deux cycles de la quinolizidine 15, analogues des cycles A et B des amino-alcools étudies.
b)- les différents amino-alcools isomères peuvent être caractérisés par l'étude de la vibration de valence de la liaison O-H, celle-ci pouvant apparaître sous forme d'une bande OH libre ou OH lié par formation d'une liaison hydrogène intra-moléculaire avec le doublet de l'azote.
En considérant uniquement les conformations les plus stables, l'examen du tableau 1 conduit aux observations suivantes :
- la série d'amino-alcools B est caractérisée par la présence simultanée sur les spectres IR de bandes "transquinolizidine" entre 2650 et 2800 cm-1 et d'une bande OH lié ; dans le tableau I, cette éventualité est notée de façon abrégée : T(+) et OH(+)
- la série A est caractérisée par l'alternance des signes: T(+)OH(-) et T(-)OH(+)
L'étude IR des deux amino-alcools obtenus à partir de la sécurinine montre que ces deux dérivés appartiennent à la série A :
C13H23NO, 14a, F 163° IR : T(+) 2682, 2760 ; OH(-) 3620
C13H13NO, 14b, F 60° IR : T(-) ; OH(+) 3505
Ce résultat permet d'attribuer à la sécurinine la configuration 1a (ou la configuration inverse 1b) dans laquelle l'hydrogène 14 occupe la position endo.
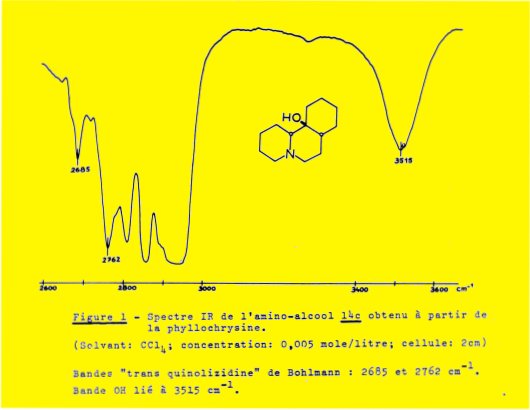
L'hydrogénation catalytique (charbon palladié) de la phyllochrysine conduit à un dérivé "hexahydrogéné" C13H21NO2 qui, après réduction par l'hydrure de lithium et d'aluminium, fournit l'amino-alcool 14c, C13H23NO, F 57 :
IR T(+) : 2685, 2762 OH(+) : 3515
Les résultats observés sur le spectre IR (figure 1) permettent de ranger ce dérivé dans la série d’amino-alcools B et par conséquent d'attribuer à la phyllochrysine la configuration 1c (ou l'inverse 1d) ; cette attribution est en accord avec les résultats de l’analyse cristallographique de l'iodométhylate de cet alcaloïde à l'aide des rayons X par Mme PASCARD.
La structure de l'amino-alcool 14c ne peut pas être établie par le seul examen du spectre IR puisque les deux amino-alcools épimères de la série B possèdent la même caractéristique, T(+) et OH(+) ; la synthèse par SAITO et coll. de l’isomère 14c sous forme racémique, identique au dérivé de dégradation de la phyllochrysine, a permis de préciser cette structure.
Le quatrième isomère 14d n'a pas pu être obtenu par hydrogénation catalytique de la phyllochrysine en présence de nickel Raney, ni par voie synthétique.
L'étude IR des trois amino-alcools 14a, 14b et 14c, obtenus à partir de la sécurinine et de la phyllochrysine permet de vérifier l'exactitude de la classification proposée au tableau I qui apparaît comme un critère bien approprié à l'établissement de la configuration de molécules apparentées par leur structure à la sécurinine ; nous avons pu utiliser cette méthode dans l’étude de la stéréochimie de la phyllantine 9 qui correspond à la méthoxy-12b sécurinine (chapitre V).
2) Configuration absolue du carbone 14
La configuration absolue du carbone 14 de la sécurinine ou de son inverse optique la virosécurinine a été établie par dégradation de ces deux alcaloïdes en acide N-benzoyl pipécolique 16 ; les différentes étapes de la dégradation sont décrites par le schéma suivant :
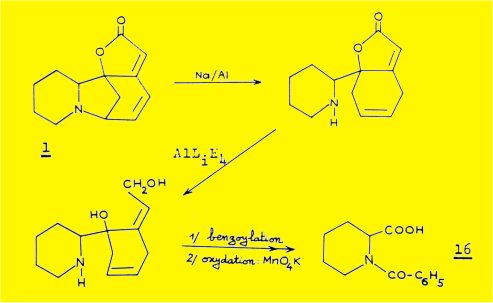
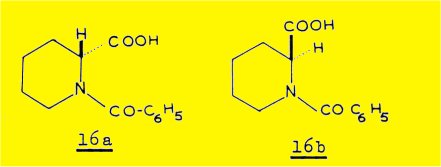
La dégradation de la sécurinine a conduit Z. HORII et coll. à l'isolement de l'acide D(+) N-benzoyl pipécolique 16a.
La même dégradation effectuée à partir de la virosécurinine par T. NAKANO et coll. fournit l'acide L(-) N-benzoyl pipécolique 16b.
3 ) Configuration absolue du carbone 1.
SADOTA et coll. ont obtenu, par dégradation de la sécurinine, l'a-cétol de formule 17 :
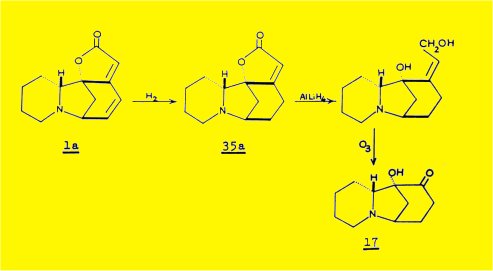
L'application de la règle des octants à la courbe de dispersion rotatoire du dérivé 17 dans la zone d’absorption du carbonyle (vers 300 mm) permet d'attribuer la configuration absolue S au carbone 1.
La connaissance de la configuration relative des carbones 1 et 14 et de la configuration absolue de l’un de ces deux carbones conduit à établir la configuration absolue de la sécurinine qui doit être formulée 1a ; la virosécurinine possède la configuration inverse 1b
4) L'analyse cristallographique à l'aide des rayons X du bromhydrate de sécurinine réalisée par S. IMADO et coll. confirme ce résultat en établissant la configuration 1a pour cet alcaloïde.
Avant d'aborder l'exposé de nos recherches, il nous a paru indispensable de décrire les travaux relatifs à rétablissement de la structure de la sécurinine par S. SAITO et coll. et l. SADOTA et coll., ainsi que celle de son antipode optique, la virosécurimine, par T. NAKANO et coll.
Après la parution de la structure de ces deux alcaloïdes, nos efforts ont porté sur l'étude de trois alcaloïdes de structure apparentée à celle de la sécurinine : la phyllochrysine, la phyllantidine et la phyllantine ; nous avons adapté à ces problèmes particuliers certaines méthodes mises au point par les auteurs japonaise
CONCLUSION
De 1962 à 1965, l'étude chimique des constituants de différentes espèces végétales de la famille des Euphorbiacées (Securinega suffruticosa, Securinega virosa Phyllantus discoïdes) a permis de trouver un type nouveau d’alcaIoïdes dont le chef de file est la sécurinine.
En Juin 1962, S. SAITO et coll. proposaient pour la sécurinine la formule plane 1.
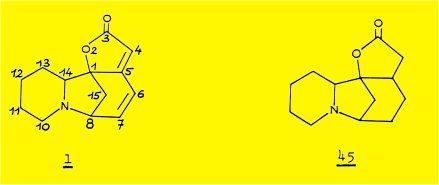
L'hydrogénation catalytique de la sécurinine conduit en plus du produit normal d'hydrogénation des deux doubles liaisons, la tetrahydrosécurinine 45, à un produit neutre C13H21NO2 correspondant à un dérivé hexahydrogéné.
La structure plane la plus probable proposée par SAITO est donnée par la formule 2 (OH : 3380 cm-1 ; N-CO : 1630 cm-1) ; en effet, la déshydrogénation en présence de charbon palladié à 290° permet d'obtenir la o-tolyl-2 pyridine 3 ; l'obtention de ce dernier produit permet d'écrire la structure partielle A comportant 12 des 13 atomes de la molécule.
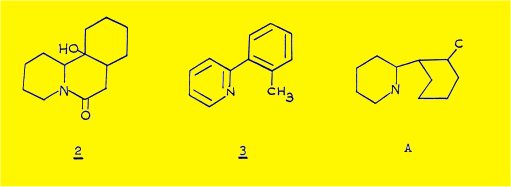
La formation du dérivé hexahydrogéné 2 doit résulter d'une hydrogénolyse de type allylique de la liaison C8-N, suivie de la formation d'une fonction lactame et d'une fonction alcool tertiaire par suite de l'attaque de la lactone par la fonction aminé secondaire libérée intermédiairement (voir introduction).
En même temps (Juin 1962) T. NAKANO et Coll. proposaient la même formule plane 1 pour un alcaloïde extrait du Securinega virosa, dénommé virosécurinine (inverse optique de la sécurinine).
Le traitement de cet alcaloïde par le zinc et l'acide sulfurique fournit un dérivé inattendu C13H15NO de formule plane 5 (N-CO : 1657 cm-1) ; la réduction par AlLiH4 de la fonction lactame conduit à la benzo(a)quinolizidïne 8b identifiée par comparaison avec un échantillon synthétique
I. SADOTA et coll. ont utilisé la même réaction pour établir la structure de la sécurinine ; celle-ci conduit à la benzo(a)quinolizidine 8a, forme énantiomère de celle obtenue à partir de la virosécurinine.
Comme dans le cas du dérivé hexahydrogéné 2, la formation du dérivé 5 doit faire intervenir une rupture hydrogénolytique de la liaison C8-N ; l'aromatisation du cycle C est due à la déshydratation du lactame-carbinol formé intermédiairement (mécanisme, voir introduction ) .
L'extraction des racines du Phyllantus discoïdes nous a permis d'isoler quatre alcaloïdes : sécurinine 1a, phyllochrysine 1c. phyllantine 9 et phyllantidine 10.
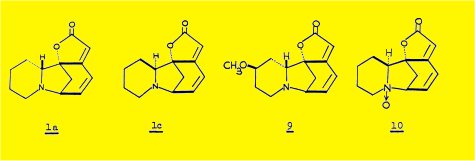
Peu de temps après la parution des trois travaux précédents, l'interprétation détaillée du spectre de RMN de la sécurinine par la méthode de double résonance, nous permettait de confirmer la structure proposée seuIe compatible avec tous les faits connus jusqu'alors.
L'étude parallèle des trois autres alcaloïdes nous a permis de conclure que la phyllochrysine est un diastéréoisomère de la sécurinine et la phyllantine la méthoxy-12b sécurinine ; la phyllantidine, identifiée au N-oxyde de la phyllochrysine pourrait n'être qu'un artefact produit par oxydation au cours de l'extraction.
La structure plane de la phyllochrysine et la phyllantine a été établie par dégradation à l'aide de l'acide sulfurique et le zinc ; on obtient respectivement les molécules 5b et 11a, qui après réduction par AlLiH4 donnent 8b et 12a.
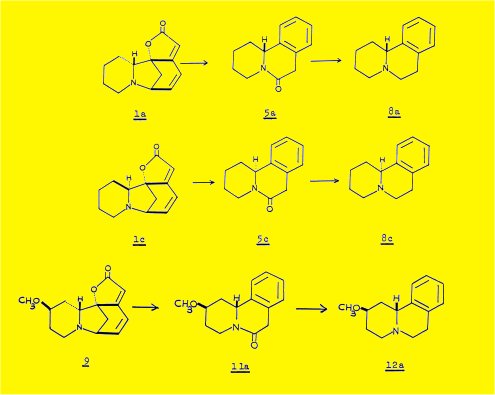

L'obtention de la méthoxy-12 benzo(a) quinolizidine 12a. par dégradation de la phyllantine, nous a conduits à envisager une synthèse des deux diastéréoisomères possibles de formule plane 12, en vue de discuter la stéréochimie des centres 12 et 14.
La synthèse mise au point constitue une méthode de préparation des molécules isomères 12a et 12c et une nouvelle méthode de préparation de la bën;zo(a) quinolizidine elle-même ; la matière de départ est l'isoquinoléine ; au cours de cette synthèse nous avons mis au point une nouvelle méthode de préparation de la déhydro 3,4 isoquinoléine 55.
La benzo(a)quinolizidine 8 obtenue sous forme racémique par synthèse présente des spectres IR (en solution) et de RMN identiques à ceux des antipodes 8a et 8b dérivant de la sécurinine et de la phyllochrysine.
Ce résultat permet de confirmer la structure plane de la phyllochrysine et de dire que la configuration absolue du carbone 14 est l'inverse de celle de la sécurinine.
L'examen de la formule plane 1 montre la présence de deux éléments d'asymétrie ; l'un d'eux est formé par les carbones asymétriques 1 et 8 constituant les têtes de pont d'un système bicyclique du type [3.2.1] ; l'autre élément d'asymétrie est constitué par le carbone 14 ; un rôle dans la distribution spatiale de la molécule doit être attribué à l'atome d'azote dont le doublet libre peut adopter une conformation préférentielle.
Par conséquent à la formule plane 1 doivent correspondre quatre formes possibles parmi lesquelles trois sont connues ; nous avons montré que la sécurinine et la virosécurinine sont deux antipodes optiques et que la phyllochrysine est un diastéréoisomère de ces deux molécules ( chapitre II ).
Le problème stéréochimique a été abordé par des méthodes différentes : dégradations chimiques (S. SAITO). examen des spectres de RMN (T. NAKANO ; nous démontrons qu'un tel critère n'a pas assez de fondement pour décrire la configuration des molécules étudiées) ; la contradiction qui apparaissait entre les résultats obtenus à la suite d'une étude cinétique de l'iodométhylation de la sécurinine et la phyllochrysine et les résultats précédents, nous a décidés à aborder le problème par l'analyse cristallographique de l'iodométhylate de phyllochrysine à l'aide des rayons X (Mme PASCARD.Paris).
Dans le cas de la phyllantine, la méthoxy-12 benzo(a)quinolizidine optiquement active obtenue par dégradation a pu être identifiée à l'aide des spectres IR et de RMN à la forme racémique 12a obtenue par synthèse.
La configuration relative des carbones asymétriques 12 et l4 dans la molécule initiale est ainsi connue ; de plus une étude comparative entre sécurinine et phyllantine a permis de préciser que les carbones 1, 8 et 14 avaient même configuration absolue dans les deux cas ; la phyllantine correspond à la méthoxy-12b sécurinine 9 (chapitre V).
L'étude par dichroïsme circulaire des molécules 1a, 1c, 9 et de certains dérivés nous a permis d'établir une correspondance entre les courbes obtenues et certaines caractéristiques structurales dues à la rigidité des systèmes étudiés : système diénique tordu, interaction transannulaire entre l'azote et le système conjugué (chapitre III).
L'étude par spectrométrie de masse de ces mêmes molécules à l'aide de la technique de double focalisation a permis d'expliquer certaines coupures peu prévisibles (chapitre IV) ; les mécanismes proposés sont vérifiés par l'examen des spectres de certains dérivés deutériés de la sécurinine.
La sécurinine et ses disatéréoisomères, la virosécurinine et la phyllochrysine (ou allosécurinine) constituent une nouvelle série d'alcaloïdes ; il faut mentionner en plus de ces trois représentants, d'autres alcaloïdes de structure très voisine découverts récemment : la norsécurinine 44, le norsécurinol, la viroallosécurinine, la phyllantine 9 et la sécuritidine.
Il est remarquable de constater que tous les diastéréoisomères possibles de formule 1 sont fournis par la nature : sécurinine, virosécurinine, phyllochrysine (allosécurinine) et viroallosécurinine.
Il est remarquable aussi de constater la coïncidence des efforts entrepris de façon indépendante pour établir la structure de la sécurinine par des chercheurs de différentes nationalités, au cours des années 1962-1965 : trois groupes de chercheurs japonais, un groupe de chercheurs hindous de l'université de Calcutta, un groupe de chercheurs chinois de l'université de Pékin et nous-mêmes.
MOTS CLEFS : alcaloïde / asymétrie / caractéristique / carbone / configuration / cycle / dégradation / dérivé / double / élément / étude / euphorbiacée / fonction / formation / formule / hydrogénation / IR / isomère / liaison / méthode / molécule / phyllantine / phyllantus / phyllochrysine / proton / quinolizidine / racine / réduction / RMN / securinega / sécurinine / spectre / structure / synthèse / virosécurinine