Thèse présentée à la faculté des sciences de l’Université de Paris
pour obtenir le grade de Docteur de l’Université
par
Germain SAINT-RUF
CONTRIBUTION A L'ETUDE DES HYDROCARBURES AROMATIQUES CONDENSES DERIVES DU FLUORENE ET DE LEURS ANALOGUES HETEROCYCLIQUES
soutenue le 16 mars 1959
devant la commission d’examen :
Amiel, président
Fréon, Piaux, examinateurs
INTRODUCTION
Depuis la découverte du fluorène (I) par BERTHELOT dans l'anthranène brut et les huiles lourdes du goudron de houille et sa première synthèse par BARBIER en 1867, cet hydrocarbure ainsi que ses dérivés substitués ont fait l'objet de nombreuses recherches, en raison notamment des propriétés cancérogènes remarquables que possèdent l'amino-2 fluorène (II) et le N-acétaminofluorène.
Par contre les hydrocarbures polycycliques condensés renfermant le squelette du fluorène, sont peu connus et peu étudiés bien qu'ils présentent un grand intérêt tant au point de vue chimique qu'au point de vue biologique.
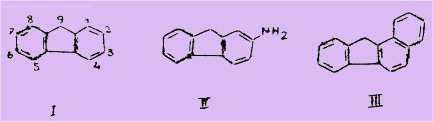
En effet, la présence de certains d'entre eux a été signalée dans les goudrons de houille à côté du fluorène lui-même. C'est ainsi que le benzo-I,2 fluorène (III) connu sous le nom de chrysofluorène et le benzo-2,3 fluorène (IV) appelé isofluorène peuvent être extraits des goudrons de houille (fraction E = 390-400°).
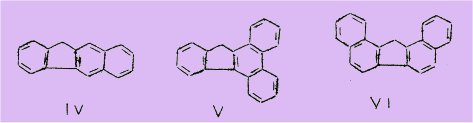
Par ailleurs, plusieurs de ces substances dérivées du fluorène sont cancérogènes. C'est le cas par exemple des trois dibenzofluorènes, le dibenzo-I,2,3,4 fluorène (V), le dibenzo-I, 2,7,8 fluorène (VI) et le dibenzo-I,2,5,6 fluorène (VIII).
De plus, ce dernier corps a retenu l'attention des biochimistes à un double titre. En effet, outre son activité cancérogène, il possède, comme l'ont révélée les expériences de BADGER, HADOW HEWETT et ROBINSON, la propriété de ralentir ou d'empêcher la croissance de certains cancers greffés chez la souris ; de leur côté, LACASSAGNE, BUU-HOI et RUDALI ont montré que ce dibenzofluorène se comporte comme un inhibiteur d'hydrocarbures fortement cancérogènes tel le méthyl-20 cholanthrène (VIII), cette inhibition étant due à un mécanisme de compétition biochimique entre les deux substances pour leur fixation sur les récepteurs protéiques responsables du contrôle de la croissance et de la division cellulaires.
Mais, faute d'une méthode adéquate et générale de préparation, le nombre de composés connus et appartenant à ce groupe demeure jusqu'à présent assez modeste.
Les anciennes méthodes de synthèse déjà peu nombreuses, variaient d'un composé à son homologue, voire à son isomère et comportaient de nombreux stades souvent d'exécution compliquée.
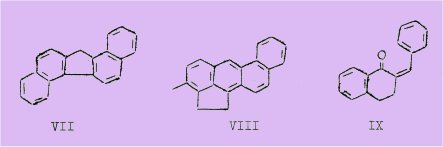
Un grand progrès fut réalisé lorsqu'en 1942 BUU-HOI et CAGNIANT mirent au point une méthode simple pour préparer le dibenzo-I,2;5,6 fluorène et facilement applicable à la synthèse d'autres hydrocarbures du même groupe.
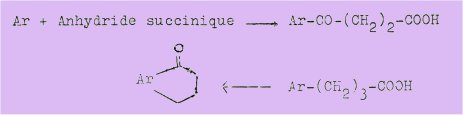
Elle était basée sur la réaction de cyclodeshydratation, au moyen de l'anhydride phosphorique, de la benzylidène-2 tétralone-I (IX) découverte par RAPSON et SCHUTTLEWORTH en 1940.
Le schéma suivant résume la synthèse de BUU-HOI et CAGNIANT :

Ils ont pu grâce à cette méthode, obtenir plusieurs hydrocarbures fluoréniques à cinq et six cycles.
Dans le cadre des recherches effectuées dans les laboratoires de chimie organique de l'Institut du Radium, concernant les molécules polycycliques condensées, il nous a paru intéressant d'appliquer cette méthode à la synthèse de représentants nouveaux de la classe des "fluorènes", afin d'étudier les possibilités et les limites d'une telle généralisation d'une part, et d'autre part, d'examiner les propriétés physico-chimiques et biologiques des substances nouvelles ainsi obtenues.
Nous avons concentré notre attention sur des composés ayant le plus grand nombre de cycles possible et dans lesquels interviennent outre le squelette du fluorène, les noyaux d'autres hydrocarbures fondamentaux ou d'hétérocycles apparentés à ces derniers.
Il y a deux ans, pour l'obtention du DIPLOME D'ETUDES SUPERIEURES, nous avions amorcé cette étude et préparé quelques hydrocarbures fluoréniques dérivés de l'acénaphtène et du pyrènne.
Dans le présent travail, nous nous sommes proposés d'obtenir :
1°) des hydrocarbures fluoréniques comportant dans leurs molécules outre le squelette fondamental du fluorène, un ou plusieurs des noyaux suivants : naphtalène, fluorène, phénanthrène, acénaphtène, pyrène,. etc.
2°) des hydrocarbures fluoréniques portant des substituants aliphatiques,
3°) des analogues hétérocycliques (oxygénés, soufrés, azotés) de ces hydrocarbures.
Il est sans conteste, que ces différents noyaux confèrent à la molécule de fluorène un grand intérêt biochimique.
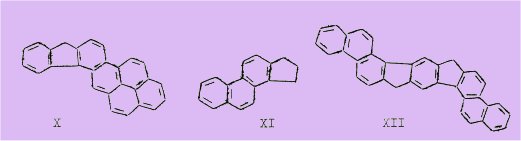
Ainsi, on peut mettre en évidence la présence du benzo-1,2-pyrène (hydrocarbure fortement cancérogène) dans le pyréno-I',2':3,4 fluorène (X), celle du cyclopenténo-I,2 phénanthrène (XI) (substance mère de toute une classe de produits d'importance biologique fondamentale : stéroïdes, hormones sexuelles, glucosides, alcaloïdes, etc.) dans le dihydro-1,5 diphénanthro-2',I':2,3 ;2", I":6,7 s-indacène (XII).
Les matières premières essentielles permettant d'accéder à ces corps sont d'une part des cyclanones dérivés de carbures aromatiques et d'autre part des aldéhydes aromatiques.
Nous avons utilisé les cétones obtenues à partir du benzène, du naphtalène, du fluorène, de 1'acénaphtène, du pyrène et pour les analogues hétérocycliques, celle dérivant du thianaphtène, du dibenzothiphène et du dibenzofuranne.
Elles ont été combinées avec : les aldéhydes benzoïque, a-naphtoïque, 5 acénaphtène, téréphtalique, l'aldéhyde p-cumnique pour les dérivés substitués et les aldéhydes -3 thianaphtène et -2 quinoléine pour les analogues hétérocycliques.
La méthode la plus simple pour préparer ces cétones cycliques, consiste à succinoyler suivant la réaction de FRIEDEL de et CRAFT, le carbure de base par une technique appropriée à chaque cas, qui conduit à un acide b-aroyl propionique que l'on réduit au moyen de la méthode de WOLFF-KISHNER modifiée selon la technique de HUANG MINLON en acide g-aryl-butyrique.
Ce dernier acide est cyclisé soit directement par action de l'acide sulfurique concentré, soit par l'intermédiaire de son chlorure et sous l'action du chlorure d'aluminium, en cétone correspondante.
Quant aux aldéhydes utilisés, ils ont été soit trouvés dans le commerce et employés après rectification, soit préparés selon des méthodes respectives à chaque cas.
C'est ainsi que l'aldéhyde-5 acénaphtène a été obtenu par action de la diméthyl-formamide sur l’acénaphtène en présence d'oxychlorure de phosphore comme agent de condensation et l'aldéhyde-3 thianaphtène à partir du chlorométhyl-3 thianaphtène selon la réaction de SOMMELET.
La condensation d'une des cétones cycliques avec un de ces aldéhydes en présence de potasse alcoolique conduit à une arylidène-cyclanone.
Cette réaction est dans tous les cas relativement rapide et donne toujours de bons rendements de l'ordre de 50 à 90 % selon les cas.
Les chalcones ainsi obtenues donnent toutes la réaction d’halochromie avec l'acide sulfurique concentré avec une remarquable gamme de nuances variant du jaune orangé au violet foncé en passant par le rosé pâle et le rouge vermillon.
Par contre ces corps sont rebelles à l'action des réac-tifs tels que la phénylhydrazine, le chlorhydrate de semicarbazide et le chlorhydrate d'hydroxylamine.
Ces chalcones soumises à l'action déshydratante de l'anhydride phosphorique en milieu xylénique rigoureusement, anhydre et chaud se cyclise avec de faibles rendements variant de 3 à 10 %, en hydrocarbure fluorénique correspondant, selon le schéma formulé plus haut.
Nous avons été amenés à formuler un certain nombre de règles qui paraissent absolues pour la réalisation de ces réactions de cyclodeshydratation :
- Le milieu réactionnel (le xylène est le meilleur solvant) ainsi que les produits doivent être rigoureusement anhydres
- La durée de réaction doit être supérieure à 20 heures et ne doit pas dépasser 36 heures ; la durée optimum semble être de 30 heures.
En modifiant la durée de chauffage pour un grand nombre de cas, nous avons observé, en effet, que pour un temps :
T < 20 heures : le rendement en produit cyclisé est très faible une grande partie de la chalcone est récupérée.
T = 30 heures : on obtient le meilleur rendement possible.
T > 36 heures : il y a résinification et carbonisation de la presque totalité du produit ; le rendement en carbure est pratiquement nul.
Par ailleurs, dans tous les cas étudiés, il y a toujours une très grande tendance à la résinification et les carbures obtenus ainsi sont d'une pureté relative. Il faut passer par l'intermédiaire de leurs picrates pour les purifier.
En outre si la méthode de synthèse de BUU-HOI et CAGNIANT s'est confirmée efficace dans la majorité des exemples soumis à l'étude, nous devons toutefois remarquer que dans certains cas, les chalcones intermédiaires se prêtaient plus ou moins bien à la cyclodeshydratation. Ce sont les molécules substituées et les molécules les moins lourdes qui sont le plus facilement obtenues et avec les meilleurs rendements.
Quand le poids moléculaire s'élève .on observe que la tendance à la résinification l'emporte de loin, en même temps qu'il y a une très grande facilité à la carbonisation, et cela quels que soient le mode et la durée de chauffage.
Ces mêmes remarques sont valables pour les analogues hétérocycliques ; diminution de rendements quand la molécule s'allonge.
Néanmoins dans le cas particulier des chalcones dérivées du formyl -2 quinoléine, nos tentatives en vue de la cyclodeshydratation de ces corps sont demeurées vaines.
Cela est dû, semble-t-il à la forte basicité que la présence de l'hétéroatome -N= confère à la molécule.
En effet, sitôt mis en présence de la chalcone, l'anhydride phosphorique se fixe sur elle, pour donner un complexe d'addition insoluble (ce qui est visible par la décoloration spontanée du solvant), et ainsi la cyclodeshydratation ne peut avoir lieu.
Même en employant de très grosses quantités de P205 nous n'avons pu arriver à un résultat satisfaisant. Nous avions également observé une telle impossibilité, dans le cas des chalcones dérivées du formyl -3 pyrène telle que par exemple la (pyrénylidène-1')-2 téralone-I (XIII) ; la molécule se scindant en deux sous l'action combinée de la chaleur et du P2O5 pour libérer le pyrène.
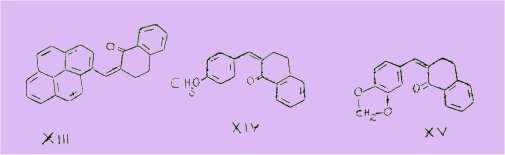
Cette coupure pourrait être due aux poids très élevés des deux noyaux aromatiques qui se trouvent de part et d'autre du groupe méthine -CH=.
Ces deux noyaux condensés reliés par un carbone aliphatique pourraient d'autre part, créer un encombrement stérique ; ce qui expliquerait que nous n'ayons pu caractériser normalement les chalcones par leurs dérivés ordinaires ; oximes, semi-carbazones, phényl-hydrazones, etc.
Signalons enfin, que BUU-HOI et CAGNIANT (II) avaient enregistré un échec identique en essayant de cyclodeshydrater la paraméthoxybenzylidène-2 tétralone-I (XIV) et la (dioxy-3',4' méthylène-benzylidène)-2 tétralone-I (XV).
Outre leurs réactions de condensation avec les aldéhydes aromatiques, les cyclanones constituent des matières premières de premier ordre pour l'obtention d'autres corps tout aussi intéressants que les chalcones ou les hydrocarbures fluoréniques.
Nous avons ainsi, dans une dernière partie de notre travail, appliqué à quelques unes des cétones cycliques employées, la réaction de FISCHER-BORSCH et la réaction de PFITZINGER ; ce qui nous a permis d'accéder respectivement à la série des carbazoles et à la série des acides cinchoniniques et quinoléines correspondantes.
Ces carbazoles qui sont des isologues des fluorènes par remplacement du méthylène-CH2-.par le groupe -NH- jouent comme, on le sait, un rôle très important au point de vue de la cancérogenèse chimique.
Ces corps donnent facilement, comme nous avons pu le remarquer des complexes d'addition fortement colorés avec les anhydrides tétrachloro et tétrabromophtalique.
Quant aux acides cinchoniniques que nous avons obtenus, ils nous ont permis de passer par leur décarboxylation et la déshydrogénation par le chloranile des produits obtenus, à des quinoléines qui ne sont autres que des dérivés de l'acridine également intéressants pour les propriétés carcinophiles de ce noyau.
Ces deux réactions de FISCHeR B0RSCH et de PFITZINGER s'effectuent très facilement dans certaines conditions avec les cétones cycliques et constituent ainsi une très bonne source de produits importants.
CONCLUSIONS
-:-:-:-:-:-:-:-:-:-:-
Au terme du présent travail nous dégageons les conclusions générales suivantes :
1°) La méthode de synthèse préconisée par BUU-HOI et CAGNIANT, que nous avons décrite et étudiée dans ses différentes variantes, constitue un excellent moyen pour accéder aux hydrocarbures polycycliques condensés renfermant le squelette du fluorène, à condition toutefois d'observer certaines règles que nous avons formulées ;
2°) Cette méthode s'applique également et avec facilité à la préparation d'analogues hétérocycliques de ces hydrocarbures fluoréniques ;
3°) ces deux groupes de corps présentent entre eux de grandes analogies tant par leurs structures que par leurs propriétés physiques et chimiques ;
4°) Les corps que nous avons obtenus offrent un grand intérêt, du point de vue biologique, non seulement en raison de leur appartenance au groupe des fluorènes dont certains sont cancérogènes, mais encore en raison de leur relation structurelle avec d'autres substances biologiques importantes : hormones, stéroïdes, etc.
5°) Enfin parallèlement nous avons eu l'occasion d’étudier, deux autres séries de corps à noyaux condensés : des carbazoles et des acridines obtenues par décarboxylation des acides cinchoniniques correspondants.
La plupart des substances que nous avons ainsi synthétisées, font actuellement l'objet d'essais biologiques.
MOTS CLEFS : acénaphtène / action / aldéhyde / analogue / anhydride / aromatique / cancérogène / carbazole / carbonisation / carbure / cétone / chalcone / cinchoninique / composé / condensation / cyclanone / cyclodeshydratation / décarboxylation / fluorène / goudron / hétérocyclique / hormone / houille / hydrocarbure / méthode / molécule / naphtalène / phénanthrène / polycyclique / propriété / pyrène / quinoléine / réaction / rendement / résinification / stéroïde / synthèse / tétralone / thianaphtène