Thèse présentée à la faculté des sciences de l’Université de Paris
pour obtenir le grade de Docteur ès sciences physiques
par
Jean NORMANT
CONTRIBUTION A L'ETUDE DE LA REACTIVITE DES ORGANO-METALLIQUES SOLVATES VIS-A-VIS DES HALOGENO-ETHYLENIQUES ET HALOGENO-ACETYLENIQUES
soutenue en février 1946
devant la commission d’examen :
Prévost président
Kirrmann, Barchewitz, examinateurs
INTRODUCTION
L'attaque d'un métal M par un halogénure RX, conduisant à l'organométallique RM, s'accompagne parfois de réactions secondaires d'élimination et de condensation.
Dans le cas des composés à halogène mobile (allyliques, propargyliques...) l'importance de la réaction de condensation peut être réduite en opérant dans des solvants peu «basiques» : éther, furanne.
Les composés à halogène peu mobile (halogénovinyliques, halogénoacétylèmques) donnent, au contraire, dans les solvants «basiques», tel le tétrahydrofuranne la réaction normale, sans duplication ou dismutation appréciables.
Ainsi un grand nombre d'organométalliques, et en particulier, d'organomagnésiens de structures diverses, sont maintenant accessibles avec de bons rendements.
L'action de ces organométalliques sur les dérivés halogènes peut, elle aussi, évoluer de différentes façons, principalement selon :
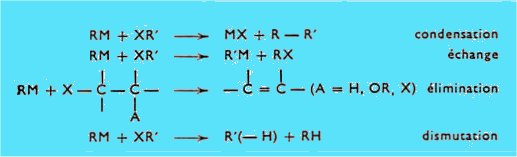
Mais si les problèmes de genèse semblent résolus de façon satisfaisante au point de vue préparatif, il n'en est pas de même pour les problèmes de réactivité.
Bien des progrès sont à réaliser notamment pour arriver à une orientation correcte de la réaction mettant en jeu un organomagnésien et un halogénure, et pour réaliser par cette voie des condensations, en particulier si l'halogénure est du type mono, ou polychlorovinylique, ou halogénoacétylènique.
L'inertie de ces composés est bien connue aussi trouve-t-on peu de données à ce sujet dans la littérature.
Divers essais de réaction entre le bromure de butylmagnésium dans le tétrahydrofuranne (THF) et les dérivés monohalogénés suivants :
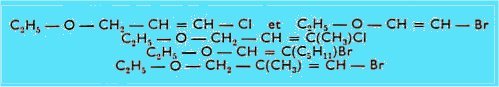
se sont soldés par un échec complet, tant au point de vue condensation, qu'élimination ou échange fonctionnel ; par contre, des dérivés vinyliques bi et trisubstitués ont donné lieu à des réactions dans les solvants plus basiques que l'éther : tétrahydrofuranne et hexaméthylphosphotriamide (hexamétapol, ou HMPT) notamment.
Ces réactions, généralement complexes, ont pu être précisées en grande partie.
Des résultats nouveaux, dont certains d'intérêt pratique ont même été obtenus dans ce domaine, avec les organomagnésiens ou d'autres organométalliques.
L'évolution de la réaction est, en particulier, sous la dépendance de la nature et du degré de substitution du composé vinylique, comme de celle du solvant.
Notre travail comprend trois parties :
Partie I. — Action de quelques organométalliques sur les composés vinyliques bisubstitués
![]()
Partie II. — Action de quelques organométalliques sur les composés vinyliques trisubstitués :

Partie III. — Étude de la réaction : R Mg X + R'X en fonction de la nature des groupes R et R' et du solvant.
CONCLUSION
Les principaux résultats de ce travail peuvent être résumés ainsi :
1° Nous avons montré que les dichloro-1,2 akènes :
R — CCl = CHCl
sont peu réactifs vis-à-vis des organomagnésiens ; seul un solvant très «basique» (cas de l'hexamétapol) permet une réaction qui mène aux chloro-1 alcynes-1 : R — C = C — Cl.
Par contre, les dichloréthylènes cis et trans peuvent réagir dans le THF sur les organomagnésiens à radical saturé, pour donner des chloro-1 alcènes-1 : R— CH = CHC1 (mélange cis-trans).
Bien que les rendements enlèvent à cette réaction un intérêt sur le plan préparatif, nos résultats diffèrent totalement des observations antérieures sur ce sujet. Ils montrent que le THF permet d'effectuer des réactions de substitution impossibles à réaliser dans l'éther.
Les dichloro-1,1 alcènes-1 R — CH == CCl2, ne réagissent que s'ils sont activés, par la présence en a de la double liaison, d'une fonction acétal ou éther-oxyde : ils donnent alors une très faible déchlorhydratation.
2° Le trichloréthylène réagit sur les organolithiens et donne de bons rendements en chloroacétylure de lithium :
Cl — C = CLi.
Les organozinciques, composés peu réactifs vis-à-vis des halogénures, sont même susceptibles de l'attaquer, dans le diméthylformamide, pour donner des dichloro-1,1 alcènes R — CH = Cl2.
Les organomagnésiens réagissent de façon très complexe.
Outre la formation prépondérante de dichloro-1,1 alcènes, et des produits acétyléniques résultant d'une élimination d'acide chlorhydrique, nous avons mis en évidence un trihalogénure saturé dont l'origine est assez difficile à établir.
Nous avons montré que le dichloro-1,2 alcène-1 : R — CCl = CHCl trans n'apparaît pas, mais que son isomère cis est formé.
Si nous proposons un mécanisme de substitution directe d'un atome de chlore par le radical du magnésien, nous n'excluons pas toutefois d'autres processus.
Dans cette réaction encore, l'hexamétapol favorise l'élimination et mène à la formation de chloro-1 alcyne-1 : R — C = C—C1.
Les alcoxydichloro-1,2 éthylènes : R — 0 — CCl = CHCl réagissent sur les organomagnésiens en donnant, d'une part un alcoxy-1 alcyne-1 : R' — C = C — O — R, et d'autre part, un alcoxy-1 chloro-1 alcène :
R' — CH = C(Cl)OR
Les organolithiens donnent au contraire de bons rendements en alcoxyacétylure de lithium : R — O — C = CLi.
Les alcoyl-thio-dichloro-1,2 éthylènes :
R — S — CCl = CHCl
se comportent de la même façon vis-à-vis des organolithiens et engendrent : R—S—C = Cli ; ces deux acétylures sont des agents de synthèse très intéressants.
Le sodium métallique provoque, par contre, l'élimination du groupe alcoxyle.
3° Nous avons réalisé diverses réactions de condensation entre des halogénures à halogène peu mobile (halogénures aliphatiques primaires, halogéno-vinyliques, et halogéno-acétyléniques) et les organomagnésiens.
Ces condensations ne donnaient jusqu'à présent (en l'absence de catalyseur) que des rendements nuls ou négligeables.
L'hexaméthyl-phosphotriamide, présente une «basicité» plus forte que celle du THF et favorise souvent la déshydrohalogénation, notamment en série vinylique.
Il permet par contre de condenser des organomagnésiens saturés sur les bromures saturés et les bromo-1 acétyléniques, et inversement, les magnésiens acétyléniques sur les bromures saturés.
Les rendements de ces réactions leur donnent un intérêt préparatif.
Le THF autorise d'autre part la condensation d'un halogénure saturé sur un organomagnésien vinylique, avec un bon rendement.
Enfin nous avons réalisé la synthèse de quelques acétals insaturés conjugués : acétylénique-éthyléniques ou biacétyléniques, qui n'étaient pas connus :
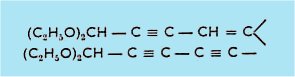
et
![]()
Notre étude tend à montrer, que vis-à-vis de la réaction de condensation :
il 'existe pas de solvant «universel» susceptible d'améliorer les résultats dans tous les cas possibles.
Au contraire, chaque réaction particulière se fait avec un rendement optimum selon le solvant utilisé, ce dernier étant caractérisé, pour une part, par sa «basicité».
Le choix du solvant dépend de la nature des groupes R et R', de la mobilité de l'halogène, et de l'aptitude à la déshydrohalogénation.
La connaissance de la structure exacte des réactifs de Grignard permettra sans doute de justifier ce choix et de le rendre moins empirique.
Si les acquisitions récentes, dans ce sens, ont permis une meilleure interprétation de l'action des organomagnésiens sur les composés carbonylés, il règne par contre une grande incertitude quant au mécanisme de leur action sur les dérivés halogènes; et les condensations que nous rapportons ici devront s'expliquer à la lumière d'une théorie des organométalliques solvatés.
MOTS CLEFS : acétal / acétylénique / action / alcène / alcyne / basicité / bromure / composé / condensation / dérivés / éther / halogène / halogénure / lithium / magnésien / mécanisme / organolithien / organomagnésien / organométallique / réaction / rendement / solvant / substitution / tétrahydrofuranne / vinylique