Thèse présentée à la faculté des sciences de l’Université de Paris
pour obtenir le grade de Docteur es sciences
par
Robert GOUTAREL
RECHERCHES SUR QUELQUES ALCALOIDES INDOLIQUES ET LEURS RELATIONS AVEC LE METABOLISME DU TRYPTOPHANE ET DE LA DIHYDROXY-PHENYLALAMINE
soutenue en 1954
devant la commission d’examen :
G. Dupont, président
C. Prévost, C. Fromageot, examinateurs
INTRODUCTION
Les recherches que je poursuis depuis près de 20 ans dans le laboratoire de Pharmacie galènique de la Faculté de pharmacie de Paris sous la direction de Monsieur le Professeur M-M. Janot ont portées principalement sur les alcaloïdes indoliques.
C'est ainsi qu'ont été étudiés les alcaloïdes de trois familles botaniques :
A - Rubiacées Pseudocinchonées : Corynanthine, Yohimbine et isomères, Mayumbine d- Yohimbine, Corynantheine, Corynanthéidine.
Rubiacées Cinchinées : Cinchonamine et Quinamine, Aricine.
B – Logianacées : Alcaloïdes de Gelsemium serpervirens : Sempervirine, Gelsemine, Gelsemicine
alcaloïdes de Gelsemium elegans ; alcaloïdes de Strychnos Holstiine.
C – Apocynacées : Alcaloïdes de l'Iboga ; Ibogaine, Ibogamine
Ibolutéine.
L'établissement des structures de la Cinchonamine, puis de la Corynanthéine, fait en collaboration avec Monsieur le Professeur V. Prelog de l'Ecole Polytechnique Fédérale de Zurich nous a permis de proposer une hypothèse biogénétique des alcaloïdes indoliques et de montrer leurs rapports avec le métabolisme de la dioxy-phényl-alanine et du tryptophane, hypothèse qui indique une filiation continue entre les alcaloïdes des trois familles botaniques étudiées.
Dans ce travail, j’ai repris l'étude des alcaloïdes mineurs des quinquinas, pour préciser certains points de leurs structures encore ignorés et en particulier tâcher à établir la structure non encore connue de l'aricine.
J'ai ensuite étudié la constitution des alcaloïdes des racines de Tabernanthe Iboga Bâillon, alcaloïdes anciennement connus : Ibogaine et Tabernanthine ou nouveaux ; Ibogamine et Ibolutéine.
J'ai par diverses méthodes de dégradation établi la structure de ces alcaloïdes, ce qui m'a permis de proposer des formules en accord avec toutes les données chimiques et physiques que j'ai pu mettre en évidence,
Enfin l'établissement des formules des alcaloïdes de l'Iboga montre qu'il existe une filiation continue entre ces alcaloïdes et ceux précédemment étudiés et qu'ils rentrent dans la catégorie des alcaloïdes dérivant biogénétiquement du tryptophane et de la dioxy-phényl-alanine.
Mon exposé se divise donc en trois parties :
I. Alcaloïdes mineurs des quinquinas
- Cinchonamine
- Quinamine
Aricine
II. Alcaloïdes de l'Iboga
- Ibogaine
- Ibogamine
- Tabernanthine
- Dérivés d'autoxydation : Ibolutéine et Iboquine
III. Biogénèse et filiation des alcaloïdes indoliques des Rubiacées Loganiacées et Apocynacées et leurs rapports avec le métabolisme de la dioxy-phényl-alamine et du tryptophane.
CONCLUSIONS
Le but de ce travail était d'établir la constitution de deux groupes d'alcaloïdes : alcaloïdes mineurs des quinquinas et alcaloïdes de Tabernanthe Iboga H. Bn. et de montrer les relations qui existent entre ces dérivés indoliques dans leur filiation à partir des acides aminés : tryptophane et dihydroxy-phénylalanine.
1°) J'ai étudié trois alcaloïdes mineurs des quinquinas : cinchonamine, quinamine et aricine.
La Cinchonamine répond à la formule brute C19H24ON2. C'est un alcaloïde monobasique, le second atome d'azote étant compris dans un cycle indolique.
L'atome d'azote basique est tertiaire. L'hydrogénation catalytique conduit à la dihydrocinchonamine.
Le spectre UV de la cinchonamine est celui des dérivés a b subsbitués de l'indol, le spectre IR présente à II m une forte bande du groupe vinyle qui disparaît dans la dihydrocinchonamine».
L'oxydation chromique conduit à 2 amino-acides : l'acide vinyl-3 quinicludine carboxylique-8 et un acide de formule C16H22O7N2 dont l’examen indique que dans la cinchonamine le noyau vinyl-quinicludique est rattaché en a d'un noyau indolique.
Par acétylation de la cinchonamine, on obtient la diacétyl-allo-cinchonamine non basique, dont le spectre UV montre qu'il s'est formé une double liaison conjuguée au chromophore indolique, par ouverture du cycle quinuclidique.
L'oxydation permanganique de la diacétyl-allo-cinchonamine a donné le b-(acétoxy-éthyl-2) indol a aldéhyde dont la réduction par l'hydrure d'aluminium-lithium conduit à l'a (oxyméthyl b (oxyéthyl) indol, identique au produit synthétique.
La cinchonamine VI est l’a-(vinyl-3’ quinuclidyl-8’) b-(oxyéthyl-2) indol.
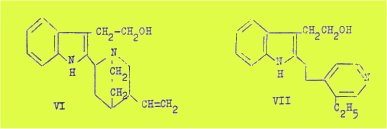
La dégradation de la déhydro-cinchonamine, obtenue par déshydrogénation de la cinchonamine par le sélénium ou par le palladium confirme cette formule.
L'oxydation de la déhydro-cinchonamine VII par le pérhydrol permet d'isoler l'acide éthyl-3 pyridine n-propionique-4 correspondant à la partie vinyl-quinuclidique de la molécule.
Enfin la déshydrogénation de la dihydro-cinchonamine par le palladium conduit par l'intermédiaire d'une anhydro-dihydro-cinchonamine, à une base ammonium quaternaire du type de la sempervirine : la cinchoflavine.
La quinamine de formule brute C19H24O2N2 correspond à une oxycinchonamine.
Le spectre UV de cet alcaloïde est du type des dérivés du dihydro-indol ; le spectre IR révèle la présence d’un groupe C-O-C.
La réduction de la quinamine par l'hydrure d’aluminium-lithium conduit à la cinchonamine.
La première formule comportant un groupe époxyde a été modifiée par Witkop qui a pu effectuer le passage inverse : cinchonamine-quinamine par oxydation de la cinchonamine par l'acide péracétique.
La quinamine répond à la formule XXXI comportant un groupement alcool tertiaire et un cycle furanoïde. Cette formule permet d'interpréter les résultats obtenus par Kirby, Robinson et leurs collaborateurs.
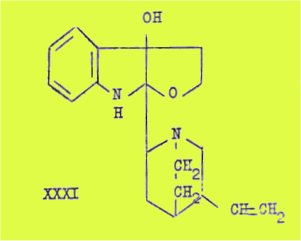
J'ai sur ces bases discuté le mécanisme de l'épimérisation de la quinamine au niveau du carbone 8 permettant d'aboutir à 2 séries de dérivés :quinamine, cinchonamine, isoquinamine et épiquinamine, épicinchonamine et épi-isoquinamine.
L'aricine de formule brute C22H26O4N2 est un alcaloïde indolique monobasique possédant 2 groupes méthoxy et un groupe C-CH3.
Le spectre UV est celui des dérivés indoliques du type de la corynanthéine présentant une absorbtion dans la région de 250 mm due à un chromophore C-OOC-C=CHOCH3 non conjugué au chromophore indolique.
La présence de cet enchaînement est confirmée par le spectre IR montrant vers 6m les bandes COO-C et C=C conjuguées.
Le spectre IR indique entre 12 et 13 mque le cycle benzénique est trisubstitué.
La saponification de l'aricine conduit à l'acide aricique C22H28O5N2 formé par ouverture d'un cycle lactonique.
L'acide aricique est hydrolisé en milieu acide en donnant un acide a aldéhydique qui se décarboxyle dans ces conditions.
L'aldéhyde intermédiaire ne peut être isolé, mais conduit par une nouvelle cyclisation à la décarboxy-aricine.
Le spectre UV de la décarboxy-aricine indique que le cycle benzénique est porteur d'un groupe OCH3 en position 5 du noyau indol.
La déshydrogénation sélénique de l'aricine permet d'isoler l'ariline de formule C19H22ON2 dont le spectre UV montre la conjugaison d'un cycle pyridique en a d'un noyau indol.
L'oxydation de l'ariline par le pérhydrol conduit à une fraction acide correspondant à un acide picolique substitué et à la méthoxy-4 ortho-aminopropiophénone.
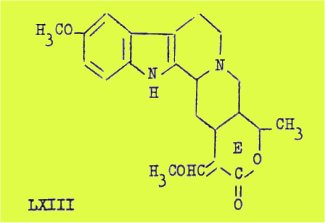
La formule LXIII proposée pour l'aricine est celle d'un alcaloïde pentacyclique, portant un groupe OCH3 en position 5 du noyau indol et dans lequel le cycle E est un cycle lactonique porteur d'un C-CH3 et de l'éther méthylique d'un aldéhyde sous sa forme énolique conjugué au groupe carbonyle.
2°) A partir des racines de Tabernanthe Ibega H. Bn. j'ai séparé par chromatographie, en plus de l'ibogaïne et de la tabernanthine déjà connues, 2 nouveaux alcaloïdes ; l'ibogamine et l'ibolutéine.
L'ibogaïne est un alcaloïde monobasique de formule brute C20H26ON2 possédant un groupe OCH3, un hydrogène mobile et un groupe C-CH3.
Le spectre UV indique que le chromophore indolique est porteur d'un groupe OCH3 et le spectre IR montre dans la région de 11,8 - 12,6 m les bandes du benzène 1,2,4 substitué.
L'oxydation permanganique permettant d'isoler l'acide méthoxy-4 N-oxalyl anthranilique démontre la position du groupement méthoxy en 5 du noyau indol.
La fusion potassique de l'ibogaïne conduit à l'isolement de 2 fragments : le diméthyl-1,2 éthyl-3 hydroxy-5 indol et la méthyl-3 éthyl-5 pyridine représentant tous les atomes de carbone, d'oxygène et d'azote de la molécule.
J'ai discuté les différentes formules possibles de l'ibogaïne compatibles avec l'isolement de ces 2 fractions.
L'oxydation chronique conduisant à un diacide (ester diméthylique C15H25O4N) représentant la partie alicyclique de la molécule, et la méthode de dégradation d'Hofmann aboutissant à une des -N-CH, ibogaïne dont le spectre UV indique la présence d'une double liaison conjuguée à l'indol, démontrent que la fraction pipéridinique de l'ibogaïne est liée à la fraction indolique par l'intermédiaire d'un hétérocycle azoté heptatomique dans lequel l'atome d'azote est en position "tryptophane" par rapport au noyau indolique.
La formule LXXV que j'ai adoptée pour l'ibogaïne comporte un 5ème cycle pentagonal, cette structure étant déduite par des considérations tirées principalement des hypothèses biogénétiques.
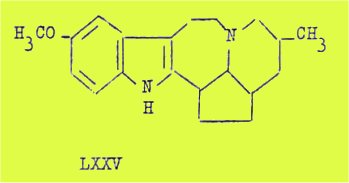
L'ibogamine de formule C19H24N2 correspond à une déméthoxy-ibogaïne, et la tabernanthine est un isomère de l'ibogaïne de formule C20H16ON2 possédant un groupe méthoxy en position 6 du noyau indol.
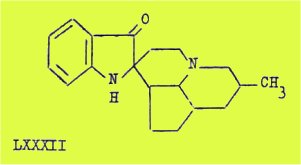
L'ibolutéine de formule C20H26O2N2 est un alcaloïde jaune et fluorescent dont le spectre UV et le spectre IR montrent qu'elle appartient au type de l'isoquinamine et est un dérivé d'un spiro-2,2' pseudo-indoxyle LXXXII
On peut la préparer par autoxydation de l'ibogaïne en solution chloroformique.
Dans la même opération on peut isoler en petite quantité un nouveau dérivé, nommé iboquine dont le spectre UV est voisin du chromophore méthoxy-quinoléique de la quinine.
Le mécanisme de l'oxydation de l'ibogaïne a été démontrée par oxydation catalytique, permettant d'isoler une b hydro-péroxy-indolénine conduisant par hydrogénation catalytique ménagée à une b hydroxy-indolénine.
Cette dernière se réarrange en milieu alcalin, par un mécanisme du type de la transposition benzylique, et conduit à l'ibolutéine.
Dans le cas de l'autoxydation en solution chloroformique, le réarrangement catalysé par les acides, est du type Wagner-Meerwein.
L'ibogamine conduit par les mêmes réactions à une déméthoxy-ibolutéine.
3°) Les hypothèses biogénétiques de Hahn dans la série de la yohimbine et de Woodward dans la série de la strychnine ont été appliquées:
- aux alcaloïdes mineurs des quinquinas : ceux-ci dérivent de la condensation du tryptophane, de la dihydroxy-phénylalanine et de l'aldéhyde fornique, l'intermédiaire théorique étant voisin du corynanthéal que nous avions isolé précédemment par dégradation de la corynanthéine.
Une cyclisation entre le groupe aldéhyde et le groupe NH conduit au noyau vinyl-quinicludique.
Par ouverture et nouvelle cyclisation, le noyau indolique peut conduire aux alcaloïdes quinoléiques du type de la cinchonine et de la quinine.
- aux alcaloïdes de l'iboga : la condensation de la tryptamine et de la dihydroxy-phénylalanine par l'intermédiaire de l'aldéhyde formique ne peut se faire que par un mécanisme inhabituel faisant intervenir un centre anionoïde en méta dans le cycle de la dihydroxy-phénylalanine.
- Enfin, j'ai étudié le mécanisme d'oxydation des alcaloïdes indolique
Dans tous les cas, le premier intermédiaire obtenu est une b -hydro-peroxy-indolénine pouvant conduire par réduction à une b -hydroxy-indolénine.
Celle-ci se réarrange en dérivé d'un spiro-2,2' pseudo-indoxyle, soit en milieu alcalin par un mécanisme de type benzylique, soit en milieu acide par un mécanisme de type Wagner-Meerwein.
Par un autre mécanisme catalysé en milieu acide l'hydropéroxy-indolénine conduit à des dérivés de la g -quinolone, ce mécanisme étant du type de celui décrit sous le nom de réaction de Camps.
Enfin les produits d'oxydation des dérivés indoliques peuvent conduire par d'autres modes de réarrangement, soit en milieu acide soit en milieu alcalin, à des alcaloïdes oxindoliques : gelsémine.
MOTS CLEFS : alanine / alcaloïde / aldéhyde / aricine / atome / autoxydation / azote / catalytique / chromophore / cinchonamine / corynanthéine / dégradation / déshydrogénation / formule / gelsémine / iboga / ibogaïne / ibogamine / ibolutéine / indol / indolénine / indolique / isoquinamine / mécanisme / oxydation / phénylalanine / quinamine / quinine / quinoléique / quinquinas / quinuclidique / rubiacées / sempervirine / structure / tabernanthe / tabernanthine / tryptophane / yohimbine