Thèse présentée à la faculté des sciences de l’Université de Paris
pour obtenir le titre de Docteur de l’Université
par
Dang-Quoc-Cuong
CONTRIBUTION A L'ETUDE DES THIOCARBANILIDES ALCOYLOXYLES ET HALOGENES D’INTERET PHARMACOLOGIQUE
soutenue le 30 mai 1962
devant la commission d’examen :
Amiel, président
Piaux, Daudel, examinateurs
INTRODUCTION
Les composés organiques possédant dans leur molécule l’enchaînement -N-C-N- présentent souvent ça très grand intérêt en chimie biologique et pharmaceutique.
A titre d'exemple, signalons que le thiouracile (I) et ses homologues (II) tels que le méthylthiouracile et le propylthiouracile
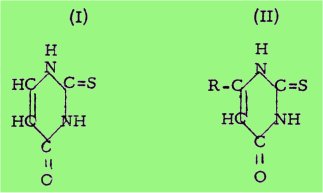
possèdent des propriétés antithyroïdiennes (ou goîtrogènes) puissantes, que l’on utilise couramment dans la thérapeutique de l'hyperfonctionnement de la glande thyroïde.
Une activité du même type se retrouve également chez la thiourée (III), laquelle, en raison de sa forte toxicité, n'est plus utilisée de nos jours en tant qu'agent goîtrogène.
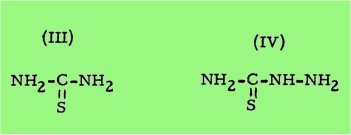
Par contre, l'étude des effets de cette substance sur la croissance de certains microorganismes a ouvert, au cours de ces dernières décades, un chapitre nouveau dans le domaine de la thérapeutique des maladies causées par les Mycobactéries et les champignons pathogènes.
Ce chapitre a été commencé pendant la dernière guerre par l'observation faite par BUU-HOI et JOUIN selon laquelle la thiourée et certains de ses dérivés tels que la thiosemicarbazide (IV) possèdent une action inhibitrice spécifique sur la croissance du bacille tuberculeux ; vers la même 'époque, MAYER a fait des observations analogues sur la sulfanilylthiourée qui était alors utilisée en France comme médicament sulfamide banal.
Par la suite, DOMAGK, en Allemagne. introduisit avec succès en thérapeutique antituberculeuse les thiosemicarbazones, produits de condensation de la thiosemicarbazide avec des aldéhydes ou des cétones, et, depuis, ces mêmes substances ont également été utilisées pour le traitement de la lèpre.
Toutefois, dans un cas comme dans l'autre, la forte toxicité qu'exercent ces composés sur le foie en a limité considérablement l'usage.
Aussi, fut-ce avec un grand intérêt que fût accueillie en 1952 la découverte faite par MAYER et selon laquelle les propriétés antituberculeuses de la thiourée peuvent être augmentées considérablement par l'introduction de deux radicaux aryles en N et en N', ces radicaux portant eux-mêmes certains substituants favorables en position para (notamment des groupements alcoyloxylés) ; par ailleurs la toxicité se trouve fortement diminuée par cette substitution.
Ces travaux furent rapidement confirmés et développés en France par BUU-HOI et ses collaborateurs, et, depuis, au moins une des N, N'-di-arylthiourées ainsi étudiées, le p,p'-diisoamyloxythiocarbanilide (V) a été introduit avec succès dans la chimiothérapie antituberculeuse (on désigne par thiocarbanilide la N,N'-diphénylthiourée elle-même) comme médicament destiné à remplacer l'acide p-aminosalicylique.
Mais c'est dans le domaine du traitement de la lèpre que les thiocarbanilides p, p'-disubstitués ont remporté jusqu'à présent leurs plus grands succès.
En effet, si MAYER et ses collaborateurs avaient montré que ces substances étaient inefficaces contre la lèpre expérimentale chez le rat (laquelle est due au bacille de Stefansky, différent de l'agent de la lèpre humaine) BUU-HOÏ, s'appuyant sur des arguments biochimiques théoriques, a prédit au contraire que les composés de ce type devaient être très actifs contre la lèpre chez l'homme.
C'est ce qui fut rapidement vérifié par BUU-HOÏ et coll. dans le cas du composé (V) et de son homologue inférieur (VI), le p,p'-diéthoxythiocarbanilide, et, quelque temps après, par DAVEY et ses collaborateurs dans le cas du p-isobutoxy-p'-diméthylaminothiocarbanilide (VIl)
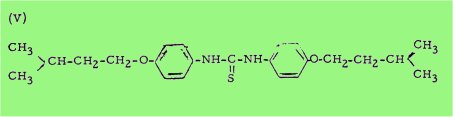
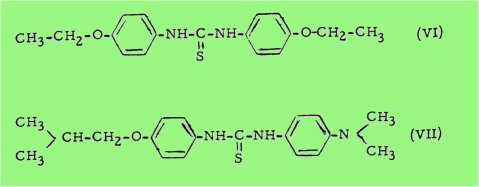
Depuis ces premiers travaux, le traitement de la lèpre par les thiocarbanilides est devenu classique.
Mais l'utilité des thiourées déborde aujourd'hui du cadre de la chimiothérapie des maladies bactériennes pour s'étendre vers les domaines des maladies d'origine virale et fongique.
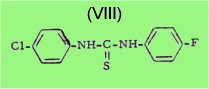
En 1954, BUU-HOÏ et ses collaborateurs ont montré en effet que certains thiocarbanilides halogènes qui sont inactifs contre les Mycobactéries possèdent en revanche une forte activité chimiothérapeutique vis-à-vis du virus de l'influenza, et c'est notamment le cas du p-chloro-p'-fluorothiocarbanilide (VIII)
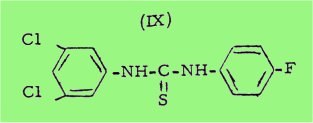
Plus récemment VANBREUSEGHEM, B.UU-HOI et coll. ont découvert des propriétés antifongiques importantes chez certains autres thiocarbanilides : le dichloro-3, 5-fluoro-4'-thiocarbanilide (IX), par exemple, est très actif contre plusieurs champignons pathogènes, aussi bien in vitro qu'in vivo, et il est déjà utilisé à l'heure actuelle contre certaines maladies fongiques externes.
Il se dégage des résultats précités que dans la molécule du thiocarbanilide simple (N,N'-diphénylthiourée), l'introduction de radicaux alcoyloxy est favorable à l'apparition de propriétés antimycobactériennes, alors que celle de substituants halogènes semble être favorable au contraire à l'apparition des propriétés antifongiques et antivirales.
Dans quelle mesure ces deux types d'activité biologique sont-ils contradictoires, et dans quelle mesure peut-on espérer trouver des thiocarbanilides qui seraient doués des deux types d'activité à la fois ?
Afin d'apporter des éléments d'une réponse à cette question, nous avons étudié la synthèse de toute une série de thiocarbanilides nouveaux, appartenant à un type peu étudié jusqu'à présent : il s'agit de thiocarbanilides possédant dans leur molécule, d'une part. un ou plusieurs radicaux alcoyloxy ou benzoyloxy, et, d'autre part. un ou plusieurs substituants halogènes.
Selon la nature de l'halogène, on peut grouper ces composés en quatre catégories :
1) les thiocarbanilides fluorés ;
2) les thiocarbanilides chlorés ;
3) les thiocarbanilides bromés ;
4) les thiocarbanilides iodés.
La synthèse de ces substances a été réalisée selon deux méthodes.
Dans le cas des composés dont la molécule est symétrique et dont la formule générale est alors Ar-NH-C(S)-NH-Ar on a recours à la réaction du sulfure de carbone (1 mole) sur une arylamine alcoyloxylée et halogénée (2 moles) en présence de catalyseurs divers (soufre, bases fortes).
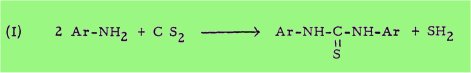
Dans le cas des composés dissymétriques, c'est-à-dire ceux correspondant à la formule générale

on utilise au contraire la réaction de condensation d'un isothiocyanate d'aryle (1 mole) sur une arylamine (1 mole).

La deuxième réaction est évidemment plus féconde que la première, puisqu'on peut y faire varier les deux facteurs, et qu'ainsi, par simple permutation circulaire, on arrive à préparer un très grand nombre de thiocarbanilides à partir d'un minimum de réactifs de départ.
Ce qui est intéressant à souligner du point de vue de la chimie théorique, c'est, d'une part. la sensibilité des deux réactions sus-mentionnées vis-à-vis des facteurs stériques et d'autre part, la réversibilité de la réaction de condensation des isothiocyanates sur les arylamines.
En effet, nous avons constaté que dans beaucoup de cas, lorsqu'il y a un substituant en position ortho par rapport à la fonction réagissante (fonction aminé ou fonction isothiocyanate) les réactions (I) et (II) ne se font pas ou ne se font qu'avec des rendements très faibles.
Dans ces cas, on observe souvent la formation, non du thiocarbanilide désiré, mais d'un thiocarbanilide symétrique correspondant à des fonctions aminés non ou moins empêchées.
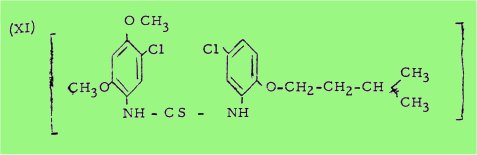
Par exemple. l'isothiocyanate de diméthoxy-2,4-chloro-5-phényle, réagissant sur l'isoamyloxy-2-chloro-5-aniline nous a fourni le tétraméthoxy –2,4,2',4'-dichloro-5,5' thiocarbanilide (X) au lieu du diméthoxy –2,4-dichloro-5,5'-isoamyloxy-2'-thiocarbanilide (XI)

Ces observations sont en accord avec les résultats antérieurement obtenus par divers auteurs, et dont les plus récents sont ceux obtenus par BUU-HOÏ et coll.
Toutefois nous avons, dans le cadre de ce travail, cherché à démontrer que les différences de réactivité des anilines substituées dans le noyau ne sont dues que partiellement à l'encombrement stérique.
Un autre facteur ne peut être négligé : il s'agit de l'influence inhibitrice ou activatrice des autres substituants du noyau sur la fonction aminé.
La réversibilité de la réaction des isothiocyanates sur les amines en général est également un phénomène connu ; on sait en effet que la décomposition thermique des N,N'-diaryl-thiourées fournit les isothiocyanates de départ, et c'est bien ce que nous avons observé au cours des présentes recherches.
Cette décomposition se produit déjà à des températures inférieures à celles de fusion des thiocarbanilides, de sorte que les points de fusion de ces derniers ne sont pas nets en général ; lorsque les températures de dissociation sont inférieures à celles d'ébullition du solvant, on conçoit qu'il ne puisse se former de thiocarbanilides, les isothiocyanates étant en général fort volatils.
Il apparaît ainsi que les deux facteurs indiqués plus haut sont de nature à limiter les possibilités de synthèse de certains types de thiocarbanilides.
En ce qui concerne enfin la préparation des matières premières nécessaires pour les présentes synthèses, signalons que nous avons préparé les isothiocyanates par la méthode de WERNER laquelle consiste à distiller lentement les thiocarbanilides symétriques avec de l'anhydride acétique
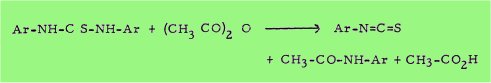
Quant aux diverses aminés aromatiques primaires utilisées, elles ont été préparées selon les méthodes suivantes :
1) les alcoyloxy-anilines sont préparées par alcoylation des amino-phénols ;
2) les alcoyloxy-anilines halogénées sont synthétisées par quatre méthodes différentes :
a- 1ère méthode : halogénation par les N-halogèno-succinimides des alcoyloxy-anilines ;
b- 2ème méthode : alcoylation des amino-phénols halogènes
c- 3ème méthode : réduction des dérivés nitrés
Nitration des phénols halogènes, alcoylation des nitrophénols résultant, puis réduction de ceux-ci.
d- 4ème méthode : réaction de Sandmeyer et de Schiemann.
Au cours de ces préparations, nous avons pu faire quelques observations intéressantes concernant la mobilité de certains halogènes dans la molécule des dérivés nitrés à réduire : par exemple, dans le cas du bromo-2-nitro-4-anisole, l'action du fer en milieu acide conduit à la perte de l'halogène, et on obtient alors la p-anisidine au lieu du bromo-2-amino-4-anisole.
De même. dans le cas du nitro-3-bromo-4-anisole on obtient la méta-anisidine au lieu de l'amino-3-bromo-4-anisole.
Les thiocarbanilides nouveaux que nous avons pu synthétiser sont au nombre de 107.
Au point de vue biologique, ils sont tous plus ou moins tuberculostatiques in vitro, ceux d'entre eux qui ont des substituants alcoyloxy en position para l'étant plus que les autres. Quant aux propriétés antifongiques de ces composés, elles sont en cours de détermination.
MOTS CLEFS : action / activité / alcoylation / aniline / anisole / antifongique / antituberculeuse / arylamine / aryle / biologique / chimiothérapie / composé / condensation / dérivé / facteur / fonction / fongique / halogène / isothiocyanate / lèpre / maladie / méthode / molécule / observation / propriété / réaction / substance / substituant / synthèse / thérapeutique / thiocarbanilide / thiosemicarbazide / thiourée / toxicité / traitement