Thèse présentée à la faculté des sciences de lUniversité de Paris
pour obtenir le grade de Docteur ès sciences physiques
par
Sylvestre JULIA
STRUCTURE MOLÉCULAIRE
ET ACTIVITÉ STROGÈNE DANS LA SÉRIE ALLÉNOLIQUE
soutenue le 16 juin 1950
devant la commission dexamen :
G. Dupont, président
Kastler, Vavon, examinateurs
INTRODUCTION
L'ovaire n'a pas seulement pour fonction de produire des gamètes femelles mais aussi de déverser dans l'organisme des hormones, en particulier celles du liquide folliculaire.
Physiologiquement, ces hormones ont entre autres propriétés, quand elles sont injectées à des rondeurs femelles castrées, celle de faire réapparaître le cycle des modifications de la muqueuse vaginale, autrement dit, de provoquer le rut ou strus.
C'est ainsi qu'Allen et Doisy ont, en 1928, établi un test portant d'ailleurs leurs noms, qui permet de mesurer l'activité strogène des substances étudiées.
Grâce à ce test, Doisy réussit en 1929 à isoler la première de ces hormones : l'strone.
Sa constitution, ainsi que celle de ses satellites : l'stradiol, l'équilénine... a été élucidée puis confirmée par synthèses totales [Bachmann, Miescher].
Etant données les propriétés pharmacodynamiques importantes de ces corps assez complexes et laborieux à préparer, on pouvait se demander s'il n'était pas possible de réaliser des substances synthétiques plus simples, plus accessibles et présentant l'activité physiologique désirable.
Les premiers résultats de ce genre furent obtenus par l'école de Cook et Dodds qui obtinrent en 1938 les premiers strogènes artificiels.
Actuellement, on connaît plusieurs centaines de ces substances possédant des propriétés strogènes et ayant des structures moléculaires très variées, souvent fort éloignées de celles des hormones naturelles.
Ici une réserve s'impose : quand on parle d'action strogène, il est indispensable de préciser les doses employées.
Or celles-ci pouvant varier à de grandes échelles, il y a intérêt à scinder en deux groupes ces produits : d'une part, ceux peu nombreux qui donnent un strus chez la rate castrée à la dose du mg. et que nous qualifierons d'oestrogènes et d'autre part, ceux qui agissent à la dose du mg. dont on peut noter l'activité strogène sans lui donner ce qualificatif.
En 1944, Heer, Billeter et Miescher attirèrent l'attention sur la grande activité physiologique d'acides dérivant des hormones naturelles par fusion alcaline.
Les savants suisses rectifièrent les formules erronées attribuées à ces corps par Hollwegg et Inhoffen et que Doisy avait décrits antérieurement.
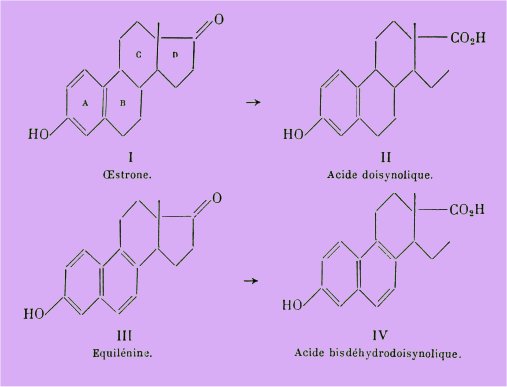
En l'honneur du savant américain Doisy ces acides-phénols II et IV furent respectivement dénommés acides doisynolique et bisdéhydrodoisynolique et leurs structures ont été démontrées par synthèse totale.
L'activité remarquable de ces acides-phénols a orienté les recherches sur les produits artificiels dans une direction nouvelle.
On s'est efforcé de simplifier la molécule des hormones naturelles et de mettre en relief leurs particularités structurales.
Dans cet esprit, Horeau et Jacques furent frappés du fait que l'ouverture du noyau D des hormones naturelles ne nuisait pas, au contraire, à l'activité strogène et pensèrent à réaliser (1947) une nouvelle ouverture, celle du noyau C pour obtenir l'acide phénol V.
En réalité, ces auteurs ont préféré synthétiser l'acide VI, homologue inférieur, qui a lavantage de ne posséder qu'un seul carbone asymétrique :
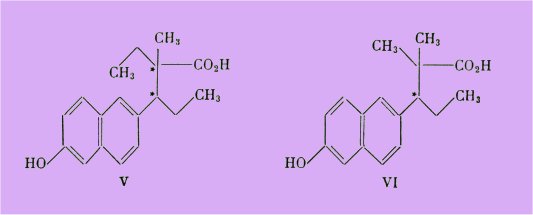
Cet acide phénol VI, dont l'étude biologique a été faite par R. Courrier, s'est révélé en effet très actif, supérieur à l'stradiol dans le test d'Allen et Doisy et aussi actif par voie buccale que par injection sous-cutanée.
Pour faciliter la nomenclature des dérivés de cet acide, ces auteurs ont proposé d'appeler l'acide amphihydroxynaphtyl propionique VII : acide allénolique en l'honneur du biologiste américain E. Allen :
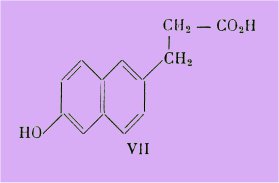
L'acide phénol ramifié VI devient donc l'acide aa-diméthyl b-éthyl allénolique.
Les propriétés physiologiques de ce nouvel strogène artificiel ont été très largement étudiées avec un matériel biologique varié. Ce dérivé possède toutes les formes complexes d'activité des hormones naturelles comme la préparation de la muqueuse utérine à l'action ultérieure de la progestérone, l'action sur la prostate du chat, sur la peau sexuelle du singe, sur la symphyse pubienne du cobaye, etc...
Ce résultat est extrêmement important en raison de la simplicité de la molécule qui ne possède plus que deux cycles.
Il nous a donc paru intéressant de rechercher les effets de nouvelles simplifications ou de modifications structurales exécutées sur cette molécule-type.
C'est dans cet esprit qu'a été réalisé le travail qui forme la présente thèse.
Je dois mon orientation vers la biochimie et plus particulièrement vers l'étude des hormones de synthèse à M. le Professeur Courrier, Secrétaire perpétuel de l'Académie des Sciences, Directeur du Laboratoire de Morphologie Expérimentale et Endocrinologie au Collège de France où il m'a accueilli avec la plus grande bienveillance. Je tiens à lui exprimer ici toute ma reconnaissance pour l'intérêt constant qu'il a bien voulu porter à mes recherches.
Que mon Maître, M. Horeau, Sous-Directeur de Laboratoire au Collège de France, trouve ici l'expression de ma profonde gratitude pour la bienveillance avec laquelle il a suivi mon travail et m'a fait profiter de ses suggestions et de ses critiques.
Une partie du présent travail a été effectuée dans les Laboratoires de Chimie de l'Ecole Normale Supérieure et de la Faculté des Sciences. J'adresse tous mes remerciements à M. le Professeur Dupont, Directeur de l'Ecole Normale Supérieure, qui a accepté la présidence de cette thèse et à M. le Professeur Vavon qui a bien voulu examiner ce travail.
J'ai en outre toujours trouvé les appuis de M. Dulou, Chef de travaux à l'Ecole Normale Supérieure et de M. Jacques, Chargé de Recherches au Centre National de la Recherche Scientifique dont les conseils et les encouragements m'ont été d'un précieux secours. Je leur renouvelle l'expression de ma reconnaissance.
Je remercie également M. le Professeur Dufraisse, Membre de l'Institut, ainsi que M. Etienne, Sous-Directeur de Laboratoire au Collège de France dont le Laboratoire a effectué de nombreuses analyses.
Les étudiants et agents de ces divers laboratoires ont droit aussi à ma reconnaissance pour l'aide amicale qu'ils m'ont apportée.
PREMIERE PARTIE
L'acide diméthyléthylallénolique VI possède deux groupements fonctionnels : un hydroxyle phénolique et un radical carboxyle.
A priori, il semble bien que la présence de ces deux groupements soit indispensable à une haute activité et que l'ablation de l'un d'entre eux pourrait avoir une répercussion sur l'activité strogène.
C'est pourquoi dans un premier chapitre, nous avons exposé la préparation du corps VIII qui ne diffère de l'acide méthoxylé IX que par le remplacement du groupement carboxyle par un radical méthyle.
Les essais biologiques de la substance VIII, réalisés par R. Courrier, montrent que la suppression du groupement carboxyle occasionne une chute importante de l'activité strogène. La dose minima faisant apparaître la kératinisation de la muqueuse vaginale chez la rate castrée est de 100 m avec cependant une durée assez prolongée de l'strus.
Miescher et ses collaborateurs observent également dans la série bisdéhydrodolsynolique que le remplacement du groupement carboxyle par divers radicaux hydrocarbonés entraîne une chute importante de l'activité.
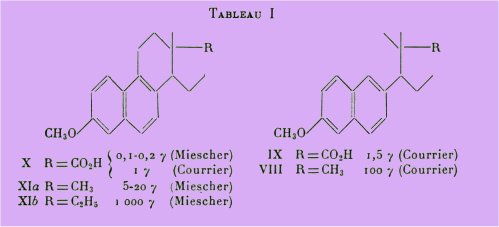
Tschopp remarque cependant que le corps (XIa), administré à des doses de 100 g provoque une durée d'strus étonnamment longue, en l'occurrence 55 jours.
Nous rappelons ici que les doses signalées ne prennent une valeur significative que si elles sont mesurées dans un même laboratoire, et que les comparaisons doivent être faites sur les résultats donnés par un même auteur.
C'est ainsi qu'un même corps, par exemple X, peut avoir des activités différentes selon les laboratoires, ces divergences sont dues aux conditions variables (primage, sensibilité d'animaux de diverses souches, etc.).
DEUXIEME PARTIE
Nous venons de voir que pour l'acide phénol IX le groupement acide est indispensable au maintien d'une fonction physiologique importante.
On peut maintenant se demander si, le radical carboxyle étant conservé, une modification concernant le second groupement fonctionnel, c'est-à-dire l'hydroxyle phénolique, aurait aussi une forte répercussion sur l'activité strogène.
C'est ainsi que nous avons procédé à l'ablation de l'hydroxyle phénolique pour obtenir des acides tels que XIIa et b, dont la préparation fait l'objet du second chapitre :
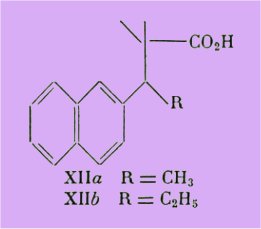
Ces acides désoxyallénoliques se sont révélé encore fortement actifs, respectivement à 100 et 10 g et montrent que la suppression de l'hydroxyle phénolique atténue de façon bien moins sensible l'activité strogène, qui est environ 10 fois moindre que celle de leurs homologues méthoxylés.
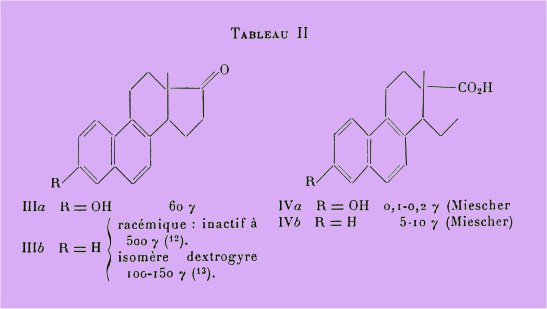
Ce fait est intéressant à rapprocher de la série bisdéhydrodoisynolique (IV) voisine, où la même opération diminue de 50 fois l'activité.
Cependant, ainsi que le montre le tableau II, les résultats sont variables dans les autres séries. En parti-culier Bachmann et Wilds ont préparé les deux racémiques de la désoxyéquilénine qui sont inactives à 500 g alors que Prelog et Fuebrer signalent avoir isolé des urines de jument gravide une forme optique droite de la désoxyéquilénine, active à 100-150 g.
Finalement, dans le cas du diéthylstilbstrol XIII, Brownlee et Green observent que l'ablation de l'un des deux groupements phénoliques ne diminue que de 4 fois l'activité.

C'est ainsi que la même opération chimique a des répercussions variables sur l'activité biologique, quand on passe d'une série à l'autre.
Une petite marge d'erreurs est à retenir surtout dans la série de l'équilénine, en raison des mesures biologiques originaires de trois laboratoires différents.
Cependant il reste frappant que l'ablation de l'hydroxyle phénolique diminue l'activité de 4 fois dans la série du stilbstrol. de 10 fois dans la série allénolique et de 50 fois dans la série bisdéhydrodoisynolique.
Il y a lieu de noter ici que les substances injectées peuvent subir des modifications dans l'organisme avant d'agir sur l'ovaire. Ce métabolisme in vivo des hormones strogènes est d'ailleurs un problème assez complexe auquel Emmens a apporté une contribution intéressante qui est exposée en détail dans la mise au point de Jacques.
En particulier, à la suite des travaux de Stroud, il est acquis que des substances pratiquement inactives peuvent se transformer in vivo en strogènes qui ont pu être détectés dans les urines.
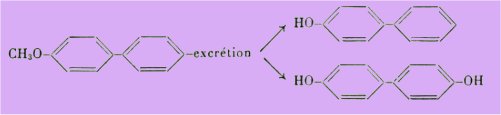
En effet, Stroud a mis en évidence dans l'organisme la déméthylation des éther-oxydes phénoliques ainsi que l'apparition de fonctions phénols sur des noyaux aromatiques qui en étaient dépourvus.
C'est ainsi que le méthoxy-4 diphényle est partiellement excrété sous forme d'hydroxy-4 diphényle et de dihydroxy-4.4' diphényle, ce qui fait apparaître un métabolite strogène alors que le corps injecté ne l'est pas.
Quant à la forte activité du corps (XIIIb), il est raisonnable de se demander si elle est due au corps (XIIIb) lui-même ou au stilbstrol (XIIIa) qui en résulterait par hydroxylation in vivo, auquel cas (XIIIb) devrait être considéré comme un précurseur.
Dans la série des hormones naturelles, Marker et Rohrmann, ainsi que Prelog et Fuehrer ont mis en évidence dans les urines de juments gravides la présence de stéroïdes amputés de l'hydroxyle phénolique, ce qui fait envisager dans cette série, un métabolisme de dégradation.
Cet ensemble de faits donne une idée de la complexité des phénomènes chimiques qui peuvent avoir lieu dans l'organisme.
Il reste cependant assez frappant que le mécanisme d'hydroxylation in vivo semble avoir lieu plus facilement dans la série du stilbstrol, moins facilement dans celle des acides allénoliques et des hormones naturelles pour devenir plus difficile dans la série des acides bisdéhydrodoisynoliques.
Autrement dit, la chute d'activité constatée à la suite de lablation de l'hydroxyle phénolique mesurerait simplement l'aptitude à la réhydroxylation in vivo de cette molécule précurseur.
En considérant la formule de lacide bisdéhydrodoisynolique de Miescher (IV), on constate la présence de deux carbones asymétriques et l'existence de deux racémiques : l'acide bisdéhydrodoisynolique normal et l'acide isobisdéhydrodoisynolique qui est totalement dépourvu d'activité biologique.
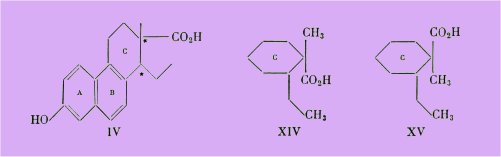
Les auteurs suisses ont été conduits à préciser que chez l'acide bisdéhydrodoisynolique normal actif, le groupement carboxyle est en cis par rapport au radical éthyle. Les figures XIV et XV mettent en évidence la stéréoisomérie des deux acides normal et iso.
Par ailleurs Ehmann et Miescher ont synthétisé un dérivé cyclisé XVI de l'acide bisdéhydrodoisynolique et ce dérivé s'est révélé totalement inactif :
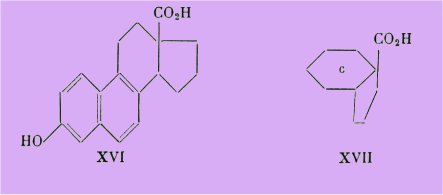
Ceci ne nous paraît pas étonnant car en l'écrivant sous la formule XVII, on voit combien sa ressemblance est plus grande avec l'acide isobisdéhydrodoisynolique XV qu'avec l'isomère actif XIV
Dans le cas de l'acide désoxyallénolique (XIIb, la présence dun carbone asymétrique unique entraîne la possibilité dun seul racémique [Jacques et Horeau ont par ailleurs dédoublé en leurs antipodes optiques]. La libre rotation carbone-carbone permet au groupement carboxyle d'occuper théoriquement dans l'espace toutes les positions par rapport au radical éthyle.
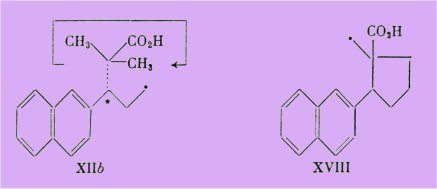
Il nous a paru intéressant de «stabiliser» une de ces positions en effectuant la synthèse du produit cyclisé XVIII, analogue à celui de Miescher. Lun des deux racémiques théoriquement possibles de cet acide XVIII, sest révèle totalement inactif.
TROISIEME PARTIE
Nous avons vu précédemment que dans la série allénolique, le maintien de la fonction acide semble avoir une grande importance alors que l'influence de l'hydroxyle phénolique semble moins prépondérante.
Il devenait ainsi indispensable d'examiner leffet que produirait l'introduction d'une seconde fonction acide dans la molécule
D'autant plus que Marker, Kamm, Oakwood et Laucius signalent une activité strogène pour le corps XX, actif à 5-10 g.
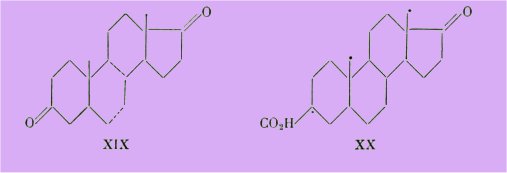
Ce fait est frappant si l'on tient compte des propriétés androgènes de la même molécule amputée du groupement carboxyle XIX.
Aussi nous sommes-nous demandé si le diacide XXI ne présenterait pas aussi une exaltation du pouvoir strogène.
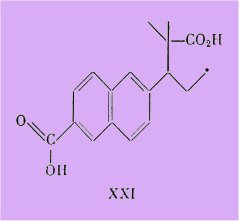
Or ce diacide dont la synthèse fait l'objet du troisième chapitre, s'est révélé inactif (essayé à 100 g).
A vrai dire, en raison des considérations développées plus haut, cette inactivité pourrait être due au fait que la position du cycle éventuellement hydroxylée par l'organisme est ici bloquée par un groupement carboxyle, empêchant ainsi le métabolisme en corps phénoliques plus strogènes.
Nos résultats sont en accord avec ceux de Neher et Miescher qui ont préparé des homologues carboxylés dans les séries du stilbstrol et de l'hexstrol et enregistrent aussi une forte chute de l'activité.
QUATRIÈME ET CINQUIÈME PARTIES
Les études précédentes ont porté sur l'influence de l'ablation et de l'introduction de divers groupements fonctionnels, le noyau restant toujours naphtalénique.
Or parmi les strogènes naturels, les corps les plus actifs ne possèdent qu'un cycle aromatique, celui porteur de la fonction phénol.
C'est ainsi que l'strone I est de 30 à 40 fois plus active que l'équilénine III.
Par contre, l'acide doisynolique II issu de l'strone est moins actif que l'acide bisdéhydrodoisynolique issu de l'équilénine.
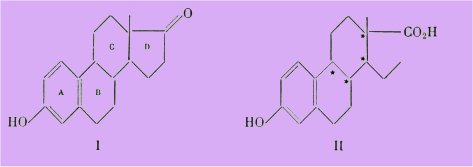
En opérant cependant par synthèse totale, Anner et Miescher ont pu isoler cinq des acides doisynoliques racémiques sur les huit théoriquement possibles, et l'un d'entre eux se révéla extrêmement actif, d'une activité supérieure à celle de l'acide bisdéhydrodoisynolique.
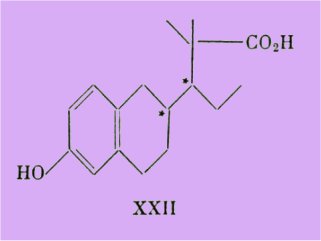
S'appuyant sur ces faits intéressants, Wieland et Miescher ont préparé un dérivé hydrogéné analogue XXII dans la série allénolique, et les deux racémiques de cet acide présentèrent des activités moindres que celle du dérivé naphtalénique.
Les substances I, II et XXII ont toutes en commun la saturation du cycle B adjacent à celui A porteur de l'hydroxyle phénolique.
En ce qui concerne l'stradiol XXIII, divers auteurs en ont réalisé des isomères où au contraire le cycle A, porteur de l'hydroxyle fonctionnel, est plus où moins saturé :
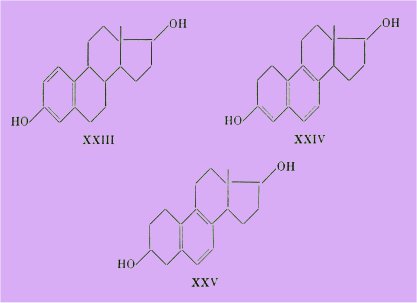
C'est ainsi que Robinson et ses collaborateurs ont préparé la cétone alcool XXIV, qui écrite sous sa forme énolique, ne diffère de lstradiol que par deux atomes d'hydrogène en moins.
Ces auteurs ne donnent malheureusement pas les essais physiologiques de cette substance.
Un modèle plus hydrogéné tel que le diol XXV a été préparé par l'école de Ruzicka.
Cette hexahydroéquilénine, obtenue sous forme de deux épimères ne présente que des activités relativement faibles, qui paraissent selon ces auteurs, comme peu compatibles avec ceux de Remesow.
Remesow signale, en effet, avoir obtenu une cétone alcool XXVI, isomère de l'strone I, dont un des racémiques aurait selon Sawatowsky une activité appréciable « du même ordre que l'strone naturelle ».
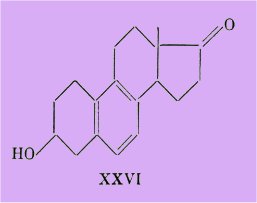
Heard et Hoffmann signalent en outre avoir isolé de l'urine de jument gravide une substance possédant la même structure que le corps de Remesow et qui donne, par réduction de sa fonction cétonique, un des deux diols déjà obtenus par Ruzicka.
Cet ensemble de faits, concernant l'influence de la saturation du cycle A sur l'activité strogène nous a paru peu cohérent.
Aussi nous sommes-nous attachés à réaliser, d'une manière systématique, la saturation progressive du cycle A dans les séries allénolique et désoxyallénolique.
C'est ainsi que nous avons préparé une cétone acide, qui écrite sous sa forme énolique XXVII, ne diffère de l'acide diméthyléthylallénolique que par 2 atomes d'hydrogène en plus.
Cette b-tétralone acide s'étant révélée inactive à 100 m, nous n'avons pas jugé utile de tester les 2 a-tétralones isomères XXVIII et XXIX préparées au cours du cinquième chapitre.
La préparation du dérivé dihydrogéné sans hydroxyle (XXXI) ainsi que de ceux tétrahydrogénés avec ou sans hydroxyle XXX et XXXII fait l'objet du quatrième chapitre.
Tous, après essais physiologiques semblent pratiquement inactifs, sauf cependant le carbinol acide XXX qui donne un rut partiel à 100 g.
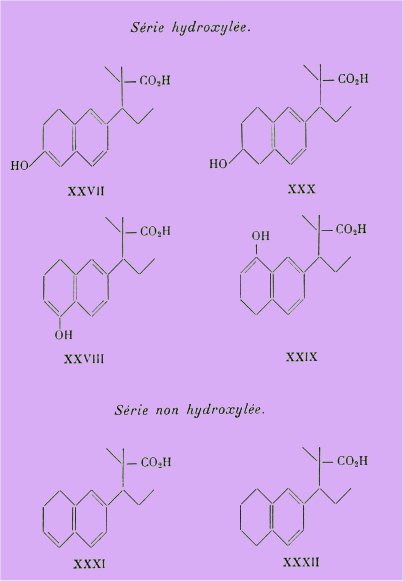
De cette étude d'ensemble on peut ainsi conclure que la saturation du cycle A diminue nettement l'activité strogène, ce qui semble corroborer les résultats de Ruzicka plutôt que ceux de Remesow.
Il est également possible, d'après les travaux de Heard et Hoffmann que les dérivés hydrogénés au cycle A soient des dérivés de dégradation éliminés dans les urines et que l'organisme n'est pas apte à les aromatiser en substances plus actives.
MOTS CLEFS : acide / activité / allénolique / bisdéhydrodoisynolique / carboxyle / cycle / dégradation / dérivé / désoxyallénolique / désoxyéquilénine / diphényle / doisynolique / équilénine / fonction / formule / hormone / isomère / strogène / strone / strus / organisme / phénol / phénolique / préparation / propriété / résultat / stilbstrol / structure / synthèse