Thèse présentée à la faculté des sciences de l’Université de Paris
pour obtenir le grade de Docteur es sciences physiques
par
Michèle GUYOT
Applications des o-carbethoxy cyclohexanones à la synthèse des xanthones naturelles
soutenue le 20 octobre 1967
devant la commission d’examen :
H. Normant, président
P. Maitte, D. Molho, examinateurs
INTRODUCTION
Le présent travail décrit l'élaboration d’une méthode originale permettant d'aboutir, dans la série des benzopyrones naturelles, à deux types de structures étroitement apparentées : les xanthones, composés a-pyroniques (l) et les benzocoumarines composés b-pyroniques (Il).
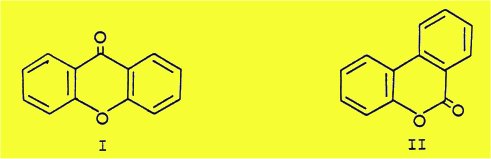
En effet, la condensation thermique entre un ester b-cétonique hydroaromatique et un phénol nous a conduit généralement à des tétrahydroxanthones que nous avons aromatisées en xanthones et, dans quelques cas particuliers, aux tétrahydrobenzocoumarines.
Les esters b-cétoniques hydroaromatiques, condensés par ailleurs avec des phénols selon la méthode de PECHMANN, nous ont permis d’obtenir des tétrahydrobenzocoumarines que nous avons aromatisées en benzocoumarines.
Genéralités
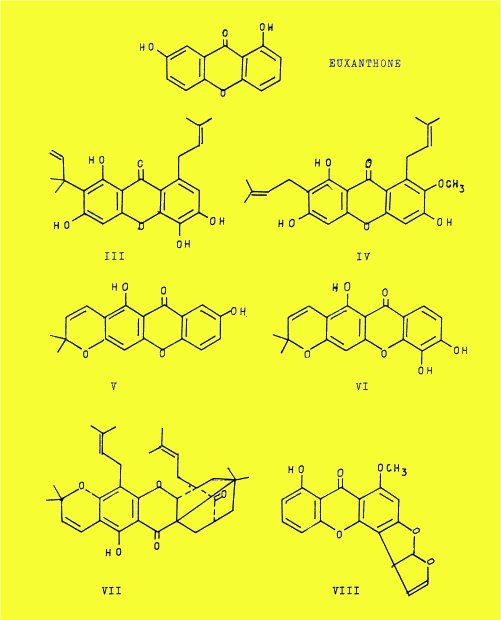
Les xanthones sont connues depuis fort longtemps puisque c'est en 1844 que STENHOUSE découvre l'euxanthone dans le "jaune indien".
Cependant, en 1956, on ne connaissait que dix-huit xanthones naturelles et c'est au cours des dix dernières années que les progrès réalisés en chimie végétale ont permis de porter ce nombre à cinquante-cinq, montrant ainsi leur importance comme constituants des plantes.
En outre, si les premières xanthones décrites sont assez simples, c’est-à-dire substituées par 2, 3 ou 4 groupements hydroxyles ou méthoxyles, on s'aperçoit maintenant qu'au squelette primitif (l) peuvent s'ajouter des chaînes carbonées ou des cycles, ce qui rend ces composés encore plus intéressants du point de vue chimique.
C'est ainsi que certaines xanthones portent une ou plusieurs chaînes diméthylallyliques : alvaxanthone (lll), mangostine (IV).
Une chaîne diméthylallylique peut subir une cyclisation, grâce à la présence d'un groupement orthophénolique, en diméthyl-2,2 pyranne : osajaxanthone (V), jacareubine (Vl).
La morelline (VIl) porte deux unités isopréniques libres, une troisième cyclisée en noyau a-a-diméthylpyranne et une quatrième reliée à un autre hydroxyle phénolique pour former un noyau bis-octénone très original.
D'autres xanthones portent un groupement furanno-furannique comme la stérigmatocystine (VIIl) et les composés voisins.
Enfin, neuf bis-xanthones ont été isolées d'un champignon Claviceps purpureus
II est donc permis de penser que de nombreux pigments, dont la structure n'est pas encore élucidée, appartiennent à cette classe de composés.
La biogenèse des xanthones dans les plantes supérieures a déjà fait l'objet de nombreux travaux, parmi lesquels on peut citer ceux de LEWIS et de NEELAKANTAN et SESHADRI, qui rattachent le noyau xanthonique aux molécules en C6C1C6 dont la biogenèse est bien connue.
Les travaux tout récents de FRANCK et coll. ont mis en lumière un processus tout à fait différent, particulier aux champignons.
Ceux-ci élaborent les bis-xanthones à partir d'éléments en C2 avec formation intermédiaire d'une anthraquinone.
NEELAKANTAN et SESHADRI ont noté la localisation des xanthones dans quelques familles botaniques limitées, en particulier, les Gentianacées, les Guttifères, les Anacardiacées et les Champignons.
Quant aux benzocoumarines (Il), ce sont des composés voisins des xanthones, puisqu'ils n'en diffèrent que par le noyau B qui est ici une a-pyrone.
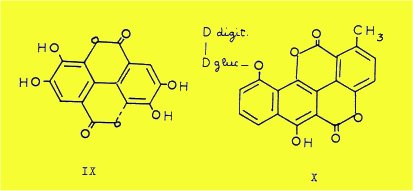
Les seuls représentants connus sont rencontrés dans les Champignons, comme l'alternariol produit par Alternaria tenuis, et chez les animaux supérieurs : l'urolithine A ou pigment I du Castoreum et l'urolithine B.
A ce groupe, il faut rattacher les dérivés du cannabinol, extrait de Cannabis indica, dont l'intérêt physiologique n'est pas à démontrer.
Dans cette série, le groupement carbonyle est remplacé par un gem-diméthyle et une chaîne carbonée s'ajoute au noyau.
Aux benzocoumarines simples se rattachent également les dérivés dibenzodilactoniques, tels que l'acide ellagique (IX), que l'on trouve à la fois dans les végétaux et dans les organes des herbivores, et la chartreusine (X), glucoside antibiotique, extrait de Streptomyces ou d'Actinomyces.
CONCLUSION.
L'ensemble de ce travail est consacré à la synthèse de composés hétérocycliques naturels : les xanthones et les benzo-coumarines.
Dans un premier chapître, nous avons établi une nouvelle méthode de synthèse des xanthones.
En effet, la condensation de la carbéthoxy-2 cyclohexanone avec différents phénols conduit aux tétrahydroxanthones, qui sont aromatisées en xanthones par le charbon palladié.
Nous avons pu remarquer l'anomalie de comportement du phloroglucinol, qui, employé dans les mêmes conditions, conduit à une tétrahydrobenzocoumarine.
Ce résultat ne restreint pas la généralité de la méthode proposée, puisque le diméthyl éther du phloroglucinol permet d'accéder à la xanthone cherchée, mais, au contraire, ouvre une nouvelle voie de synthèse des benzocoumarines dérivant de ce phénol.
La synthèse de xanthones naturelles, qui portent généralement des groupements sur leur deux noyaux aromatiques, nécessitait l'emploi de carbéthoxy-2 cyclohexanones convenablement substituées.
C'est à la synthèse de ces dérivés et à l'étude des composés permettant d'y parvenir, que nous avons consacré le deuxième chapître.
Nous avons montré, dans le chapitre suivant, que notre méthode permettait d'accéder aux xanthones naturelles en synthétisant d'une part la gentisine, et, d'autre part, l'hydroxy-2 xanthone et la méthoxy-2 xanthone.
Partant du diméthyl-2,2 hydroxy-5 méthoxy-7 chromanne, nous avons synthétisé une diméthyl-allyl tétrahydroxanthone, dérivé tétrahydrogéné d'un produit naturel : la diméthyl-allyl-2 trihydroxy-1,3,7 xanthone, isolée tout récemment sous forme de son éther diméthylique, puis la même xanthone naturelle sous forme de son dérivé dihydrogéné sur la chaîne latérale, ou isopentyl-2 hydroxy-1 diméthoxy-3,7 xanthone.
La déméthylation de cette dernière s'accompagne d'une transposition qui permet d'accéder à l’isopentyl-4 trihydroxy-1,3,7 xanthone, dérivé dihydrogéné de la mbarraxanthone, autre xanthone naturelle.
Enfin, nous avons condensé selon Pechmann les carbéthoxy-2 cyclo-hexanones substituées pour obtenir des tétrahydrobenzo-coumarines, qui ont été ensuite aromatisées en benzocoumarines.
Par ce procédé nous avons synthétisé deux benzo-coumarines naturelles : le pigment I du "castotéum" ou urolithine A et l’urolithine B.
En remplaçant les phénols par des naphtols, le même procédé nous a permis l'accès aux dibenzo-3,4,7,8 coumarines.
Parmi celles-ci la méthyl-3' triméthoxy-6,6’,6" dibenzo-3,4,7,8 coumarine est le premier produit de dégradation de la chartreusine, dont la synthèse, même partielle n'a jamais été tentée jusqu'à présent.
De plus, l'aromatisation de la tétrahydrobenzo-coumarine s'accompagne d'une décarboxylatuon et conduit à un hydrocarbure : le phényl-2 naphtalène, ouvrant peut-être une voie d'accès aux aryl-naphtalènes.
La condensation des esters b cétoniques avec divers composés phénoliques s’est donc révélée comme étant un procédé tout à fait général pour synthétiser les hétérocycles oxygénés naturels; elle pourra donc être utilisée dans d'autres cas et peut-être même être étendue aux hétérocycles azotés.
MOTS CLEFS : benzocoumarine / biogenèse / carbéthoxy / castotéum / cétonique / champignon / composés / condensation / coumarine / cyclohexanone / dérivé / diméthyl / ester / groupement / hétérocycles / isopentyl / méthode / naphtalène / phénol / phloroglucinol / pigment / plante / procédé / structure / synthèse / tétrahydrobenzocoumarine / tétrahydroxanthone / urolithine / xanthone