Thèse présentée à la faculté des sciences de l’Université de Paris
pour obtenir le grade de Docteur és-sciences physiques
par
Michel JOUANNE
SUR LA CONDENSATION THERMIQUE DE L4ANTIAROL ET DE QUELQUES POLYPHENOLS AVEC DIVERS ESTERS b-CETONIQUES ET LE PHENYLMALONATE D’ETHYLE
soutenue LE 18 MARS 1967
devant la commission d’examen :
Prévost, président
Mentzer, Normant, examinateurs
INTRODUCTION
En 1951, MENTZER et ses collaborateurs ont décrit un nouveau mode de condensation des esters b-cétoniques et des phénols aboutissant aux chromones par simple chauffage du mélange des réactifs.
Appliqué aux esters aroylacétiques, ce procédé conduit directement aux phényl-2 chromones (I) ou flavones dont les représentants naturels forment un groupe important de substances qui, libres ou .combinées avec des sucres, s'inscrivent dans la liste des pigments végétaux.

Le succès de cette réaction, dont le mécanisme vient tout dernièrement d'être élucidé par MOLHO et AKNIN, semble lié pour une bonne part à la réactivité du partenaire phénolique.
En effet, bien qu'ayant permis la préparation d'un grand nombre de dérivés oxyflavoniques connus, cette réaction dite de "condensation thermique" n'a pu encore jusqu'à maintenant être étendue à tous les phénols, notamment en série benzénique où la présence d'au moins deux fonctions phénoliques libres apparut indispensable : ainsi, comme exemples d'échecs, pouvons-nous citer des essais effectués avec le phénol ordinaire et le p-crésol.
Une partie du présent travail a précisément pour objet une contribution à l'extension de cette réaction aux dérivés benzéniques n'ayant qu'un seul groupement phénolique libre.
Parmi les monophénols susceptibles de conduire directement ou indirectement à des composés naturels par condensation thermique avec des esters b-cétoniques convenablement substitués, nous avons retenu l'antiarol ou triméthoxy-3,4,5 phénol (II) dont l'étude chimique est actuellement encore peu développée.
La découverte, ces dernières années, de flavones naturelles méthoxylées en position 5,6,7, dans la structure desquelles sanscrit ce noyau phénolique, justifiait assez bien ce choix.
Dans les nouvelles applications de la condensation thermique, objets de cet exposé, l'antiarol jouera donc un rôle prépondérant.
Par le nombre de ses dérivés obtenus avec des rendements très convenables pour ce genre de réaction et dont quelques-uns sont originaux, ce "monophénol" s'est montré prodigieusement réactif.
C’est là une révélation intéressante car, à notre avis, elle découvre à la condensation thermique des perspectives débordant le cadre restreint dévolu à un cas particulier.
Les difficultés mêmes rencontrées pour prouver la possibilité de telle ou telle condensation nous donnent à penser qu'au prix de persévérances recherches on arrivera à faire réagir les monophénols en général.
Les autres matériaux phénoliques dont il sera question appartiennent à la catégorie des polyphénols qui, d'après l’expérience de nos prédécesseurs, sont censés réagir plus aisément.
Nous aurons l'occasion de voir qu’il n’en est pas toujours ainsi.
Accessibles comme produits dérivés de la préparation de l'antiarol, nous avons cherché à condenser la diméthoxy-2,6 hydroquinone et le tétrahydroxy-1,2,3,5 benzène.
Commercialement disponibles, la résorcine et la phloroglucine ont été déjà affectées à la synthèse de nombreuses chromones.
Nous les retrouverons avec l'antiarol comme partenaires du g-
phénylacétylacétate et de l’a-phénylbenzoylacétate d'éthyle, esters qui n'avaient pas encore été étudiés comme matières premières en vue de la synthèse par condensation thermique des benzyl-2 chromones ou homo-2 flavones et des diphényl-2,3 chromones.
Enfin, avec l'étude des produits résultant du chauffage selon URBAIN et MENTZER de l’antiarol et de la chrysine avec le phénylmalonate d’éthyle, nous aborderons le domaine particulier des hydroxy-4 coumarines.
L'exposé de ce travail comprend trois parties.
La première est consacrée à l'antiarol, aux matières premières phénoliques qui en dérivent et aux esters b-cétoniques dont les préparations ont fait l'objet de manipulations personnelles.
La deuxième traite de la condensation thermique et de ses applications à la synthèse de dérivés flavoniques et assimilés.
La troisième renferme le compte-rendu de nos expériences dans les domaines des homo-2 flavones, des diphényl-2,3 chromones et des hydroxy-4 coumarines.
Pour préparer l'antiarol, nous avons tout d'abord cherché à exploiter simplement les données de la littérature.
Parmi les procédés décrits, nous avons retenu celui de WILL aménagé par CHAPMAN, PERKIN et ROBINSON que nous avons dû bientôt modifier par un choix différent des méthodes d'obtention des matières premières intermédiaires et la mise au point d'un tour de main approprié à la manipulation de la diméthoxy-2,6 hydroquinone (III) et à sa méthylation.
A défaut d'amélioration des rendements, nous avons rendu commode la pratique de la synthèse de l'antiarol au laboratoire.
Certains produits concernés par la méthode de WILL ont servi de base à des tentatives diverses : conversion du triméthoxy-3,4,5 nitrobenzène en antiarol par la méthode de GRAEBE et SUTER modifiée d’aprés un mode opératoire emprunté à un auteur moderne, acétoxylation du triméthoxy-1,2,3 benzène, élaboration d'un procédé de préparation du tétrahydroxy-1,2,3,5 benzène (IV).

La mise en oeuvre des procédés d'obtention des esters b-cétoniques n'a pas donné lieu à des recherches aussi systématiques.
Cependant nous nous sommes trouvés dans l'obligation de modifier avantageusement la technique de préparation d'un intermédiaire, l'a-phénylbenzoylacétonitrile.
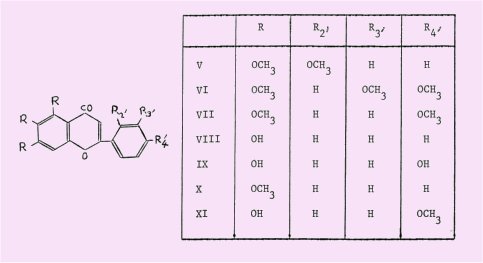
Nous nous sommes tout d'abord proposé de préparer à partir de l'antiarol et par la seule méthode de condensation thermique quelques flavones naturelles entièrement méthoxylées comme la zapotine (V) isolée en 1956 des graines de Casimiroa edulis Liave et Lex, arbre du Mexique et d'Amérique Centrale, la sinensétine (VI) trouvée en 1957 dans la pelure d'orange et l'0-tétraméthylscutellaréine (VII) tout récemment isolée du même matériau, ou hydroxylées comme la baïcaléine (VIII) et la scutellaréine (IX) connues déjà depuis longtemps et accessibles par l'intermédiaire de leurs éthers méthyliques (X) et (VII).
Nos recherches relatives à cette série de flavones ont dû être limitées aux synthèses de la baïcaléine, de la scutellaréine et de leurs éthers méthyliques.
Les difficultés rencontrées au départ semblèrent justifier la renommée primitivement attribuée aux monophénols qui plaçait nos projets dans une perspective peu favorable.
Nous avons cependant persévéré et ce sont précisément les échecs de nos premiers essais de préparation de l'O-tétraméthylscutellaréine qui nous ont amenés à concevoir une technique sûre permettant de réaliser cette synthèse.
Justifiée par les rendements obtenus, elle est spécifiquement adaptée aux préparations de dérivés flavoniques par condensation thermique de monophénols et d'esters b-cétoniques mêmes fragiles.
Son application à la synthèse de la triméthoxy-5,6,7 aza-3' flavone constitue par ailleurs une bonne démonstration de son efficacité.
A nos travaux dans le domaine des flavones se rapportent encore la synthèse de la triméthoxy-5,6,7 méthyl-3 flavone et quelques tentatives pour accéder aux diméthoxy-5,7 hydroxy-6 flavones et à la méthoxy-4' trihydroxy-5,6,7 flavone (XI) primitivement considérée comme identique à la dinatine isolée de Digitalis lanata.
Inspirés par la découverte de la siphuline (XII) et la publication de travaux sur la structure de la scandénine (XIII), les premiers essais d'application de la condensation thermique à la synthèse des homo-2 flavones et des diphényl-2,3 chromones intéressent les produits suivants : l'O-triméthylhomo-2 baïcaléine (XIV), l’'homo-2 chrysine (XV), l'hydroxy-7 homo-2 flavone (XVI), l'O-triméthylphényl-3 baïcaléine (XVII), la phényl-3 chrysine (XVIII) et l'hydroxy-7 phényl-3 flavone (XIX).


En marge de ces travaux, nous avons essayé, mais en vain, de faire réagir un amide b-cétonique à la place d'un ester.
La réaction d’URBAIN et MENTZER, développée par VERCIER et dernièrement par Mme DESCHAMPS-VALLET, est connue pour conduire aux hydroxy-4 coumarines à partir des esters maloniques et des phénols.
Pour terminer, les résultats de quelques nouvelles tentatives d'application de cette réaction retiendront notre attention.
A l'occasion de la condensation de l'antiarol et du phénylmalonate d'éthyle nous croyons avoir isolé séparément la triméthoxy-5,6,7 phényl-3 hydroxy-4 coumarine (XX) et le triméthoxy-5,6,7 isoflavonol (XXI) apportant ainsi une preuve directe de l'existence de la tautomérie coumarine-chromone mise en évidence par ARNDT et ses élèves.

La structure de la. scandénine a finalement été élucidée par PELTER et JOHNSON. Il s'agit d'une molécule d'un type différent de celui qui est présenté ici.
CONCLUSIONS
Les recherches exposées dans cette thèse concernent avant tout la chimie de l'antiarol (triméthoxy-3,4,5 phénol) et plus particulièrement la synthèse de nouvelles molécules hétérocycliques (flavones, coumarines, etc..) en partant de ce phénol, qui n'avait été jusqu'ici que très rarement étudié.
L'intérêt des substances obtenues réside dans la présence, au sein de leur molécule, de trois méthoxyles vicinaux.
Généralement les composés munis de tels groupements sont difficilement accessibles aux méthodes synthétiques en raison de la fragilité de leur édifice structural.
Par contre, ils présentent souvent de remarquables propriétés pharmacologiques.
Grâce à des recherches systématiques, nous avons trouvé que la méthode dite de "condensation thermique" peut être généralisée à la synthèse de certains hétérocycles dérivés de l'antiarol.
Mais, comme nous avons pu le montrer dans le cas de la scutellaréine, les techniques décrites dans la littérature aboutissent souvent à des échecs.
Aussi nos efforts ont-ils porté principalement sur la mise au point d'un procédé original qui a fait ses preuves dans le cas de la tétraméthoxy-5,6,7,4' flavone, et qui pourra s'appliquer également à d'autres dérivés de cette série, difficilement accessibles par les voies connues.
A l'occasion de ces recherches, nous avons également découvert les faits suivants qui, à notre avis, méritent d'être soulignés en raison de leur originalité :
1° En ce qui concerne la synthèse de l'antiarol, une technique simplifiée permettant l'obtention de ce phénol en partant de la diméthoxy-2,6 hydroquinone mais sans isolement préalable de cette matière première a été mise au point.
2° Le tétraméthoxy-1,2,3,5 benzène, particulièrement sensible à l'oxydation, a été également obtenu selon un nouveau procédé consistant, dans ses grandes lignes, en une déméthylation de la diméthoxy-2,6 hydroquinone.
La synthèse du benzoyl-2 phénylacétonitrile, précurseur de l'a-phényl-benzoylacétate d'éthyle, a été également améliorée.
4° Une réaction colorée permettant une différenciation rapide des flavones et des a-pyrones (acides déhydroaroylacétiques) qui apparaissent souvent simultanément au cours des condensations thermiques a été préconisée.
Cette réaction est particulièrement utile au cours des recherches systématiques sur l'orientation de telles condensations, en fonction de la structure des réactifs mis en oeuvre.
5° Le comportement singulier de certaines hydroquinones comme la diméthoxy-2,6 hydroquinone, incapable de subir la condensation thermique, a été souligné.
6° En ce qui concerne la synthèse des homoflavones, les meilleurs rendements de la condensation thermique ont été obtenus en partant de l'antiarol.
Ce fait est assez extraordinaire, car généralement la phloroglucine et la résorcine sont plus réactifs que le triméthoxy-3,4,5 phénol-1.
7° Une autre anomalie que l'étude chimique de l'antiarol nous a permis de découvrir concerne la formation d'un isoflavonol. Elle a lieu au cours du chauffage de ce phénol en présence de phénylmalonate d'éthyle.
A côté de la phényl-3 hydroxy-4 triméthoxy-5,6,7 coumarine, il apparaît dans ces conditions la forme tautomère correspondante, c'est-à-dire l'hydroxy-2 phényl-3 triméthoxy-5,6,7 chromone.
La formation d'un tel isoflavonol n'avait pas encore été signalée jusqu'ici au cours d'une condensation thermique.
8° Enfin pour terminer, nous signalerons la possibilité que nous offre parfois la condensation thermique d'aboutir à des coumarino-flavones, molécules bis-pyroniques encore peu étudiées.
C'est grâce à l'action du phénylmalonate d'éthyle sur la chrysine qu'une telle molécule a été obtenue. Sa structure exacte reste cependant à préciser.
MOTS CLEFS : antiarol / application / baïcaléine / benzène / cétonique / chromone / chrysine / condensation / coumarine / dérivé / ester / flavone / hydroquinone / isoflavonol / mentzer / méthode / molécule / monophénol / phénol / phénolique / phloroglucine / préparation / procédé / réactif / réaction / recherche / rendement / scandénine / scutellaréine / structure / synthèse / technique