Thèse présentée à la faculté des sciences de l’Université de Paris
pour obtenir le grade de Docteur ès sciences physiques
par
Jules JARROUSSE
CONTRIBUTION A L'ÉTUDE DE L'ACIDE DI-(PHÉNYLPYRUVIQUE)
soutenue en juillet 1937
devant la commission d’examen :
Ramart-Lucas, président
Dupont, E. Darmois, examinateurs
INTRODUCTION
Les acides a cétoniques fournissent de multiples exemples de condensation, avec les aldéhydes, avec les cétones, entre plusieurs de leurs molécules. Erlenmeyer a décrit sous le nom d'oxolactones, toute une série de composés lactoniques très particuliers, dont la plupart dérivent de l'union de l'acide phénylpyruvique et d'aldéhydes aromatiques :

Plusieurs auteurs (Genvresse puis Simon, en France; de Jong et Ludwig Wolf dans les publications allemandes) ont signalé des produits de condensation de l'acide pyruvique ou de ses éthers, et en particulier l'acide lactonique :

M. le professeur Gault a observé par la suite que certains éthers d'acides a cétoniques de la série grasse peuvent subir une aldolisation pour donner des monoéthers lactoniques :

Vers la même époque, au cours de travaux sur les acides a cétoniques de la série aromatique, M. le professeur Bougault a montré que deux molécules d'acide benzylpyruvique sont capables de se condenser en fournissant un diacide qu'il a dénommé acide di-(benzylpyruvique) :

Une élève de M. le professeur Bougault, Mlle Hemmerlé, a signalé, par la suite, que deux molécules d'acide phényl-pyruvique peuvent également s'unir par aldolisation, pour donner un acide qu'elle a désigné sous le nom d'acide di-(phénylpyruvique) et auquel elle a attribué la formule :

Si les oxolactones, dont la plupart dérivent de l'union de l'acide phénylpyruvique et des aldéhydes aromatiques, ont fait l'objet de nombreux et importants travaux d'Erlenmeyer ou de ses élèves, les acides qui proviennent de la condensation de deux molécules d'acides a cétoniques ont été beaucoup moins étudiés.
Il était donc intéressant de faire de l'un d'eux la matière de recherches plus approfondies, et telle a été l'intention de ce travail.
Pour avoir un produit d'un accès abordable, et aussi voisin que possible des oxolactones d'Erlenmeyer, nous avons choisi l'acide di-(phénylpyruvique) préparé pour la première fois par Mlle Hemmerlé.
Quelques propriétés de l'acide di-(phénylpyruvique) ont été décrites par cet auteur, en même temps que les circonstances de sa formation :
1° Sa transformation facile en une oxolactone, l'a oxo b phényl g benzylbutyrolactone, par perte d'un groupement carboxyle :

2° L'existence de monoéthers lactoniques :

qui se rapprochent par leurs propriétés des oxolactones d'Erlenmeyer et dont la saponification fournit, normalement, l'acide di-(phénylpyruvique).
Poursuivant cette étude, nos recherches ont d'abord porté sur l'hydrogénation de l'acide di-(phénylpyruvique) par l'amalgame de sodium, puis sur son oxydation par le permanganate de potassium en milieu alcalin.
Nous avons comparé les résultats ainsi obtenus d'une part à ceux qu'a signalés Erlenmeyer dans l'hydrogénation des oxolactones, d'autre part à ceux que nous avons observés dans l'oxydation de quelques-unes de ces oxolactones.
Nous avons constaté ensuite que la saponification de l'éther méthylique de l'acide a oxo b phényl g benzylbutyrolactone g carbonique peut fournir dans certaines conditions un mélange des acides phényl benzylsucciniques, stéréoisomères.
Nous avons séparé ces acides et nous avons précisé leurs caractères.
Tout en poursuivant ces recherches, nous avons noté quelques remarques au sujet de l'action méthylante du sulfate de méthyle sur l'acide di (phénylpyruvique), sur l'acide phéuylpyruvique et sur l'acide benzylpyruvique.
Nous avons adopté dans notre exposé le plan qui suit :
PLAN
CHAPITRE PREMIER
Généralités sur l'acide di-[phénylpyruvique).
1° Rappel de quelques propriétés.
2° Préparation.
CHAPITRE II
Hydrogénation de l’acide di-(phénylpyruvique).
Hydrogénation de l'acide di-(phénylpyruvique), acide a oxy b phényl g benzyl butyrolactone g carbonique.
Saponification de l'acide a oxy b phényl g benzyl butyrolactone g carbonique ; acide b phényl g benzyl ag dioxyglutarique.
Action de la chaleur sur l'acide b phényl g benzyl ag di-oxyglutarique.
CHAPITRE III
Oxydation de l'acide di-(phénylpyruvique) et de quelques oxolactones.
Oxydation de l'acide diphénylpyruvique, phényl phénylacétyl carbinol et acide benzoyl-benzylglycollique.
Oxydation de l'a oxo b phényl g benzyl butyrolactone, benzoyl benzylcarbinol.
Oxydation de l'a oxo ba diphényl butyrolactone.
Oxydation de l'a oxo b phénylbutyrolactone.
CHAPITRE V
Remarques sur l'action méthylante du sulfate de méthyle.
Action du sulfate de méthyle sur l'acide di-(phénylpyruvique).
Action du sulfate de méthyle sur l'acide phénylpyruvique.
Action du sulfate de méthyle sur l'acide benzylpyruvique.
CONCLUSION
La contribution que nous avons apportée à l'étude de l'acide di-(phénylpyruvique) peut être résumée ainsi :
1° L'acide di-(phénylpyruvique), d'abord décrit comme étant un diacide :

doit être considéré, quand il est isolé et sec, comme un mono-acide lactonique :

dont le groupement lactone est très mobile.
2° L'hydrogénation de l'acide di-(phénylpyruvique) par l'amalgame de sodium, fournit, en milieu acide, l'acide a oxy b phényl g benzyl butyrolactone g carbonique, fondant à 225° :

Cet acide lactonique s'hydrate sous l'influence des alcalis pour donner l'acide b phényl g benzyl ag dioxyglutarique fondant vers 140° :

L'acide b phényl g benzyl ag dioxyglutarique (IV), main-tenu quelques minutes à l'état fondu, perd de l'eau pour donner un acide lactonique fondant à 136°, isomère de l'acide lactonique fondant à 225° (III) et représenté par l'une des formules :

2° L'oxydation de l'acide di-(phénylpyruvique) par le permanganate de potassium et en milieu alcalin, fournit de l'acide oxalique et un acide b cétonique peu stable, l'acide benzoylbenzylglycollique :

Cet acide subit dans le milieu alcalin la décomposition cétonique. Il devrait donner le benzoylbenzylcarbinol :

Mais le benzoylbenzylcarbinol (VII) se tautomérise dans ces conditions et l'on obtient finalement le phénylphényl-acétylcarbinol (VIII) :

3° L'acide di-(phénylpyruvique) réagit vis-à-vis du sulfate de méthyle comme un monoacide, lactonique et énolique et fournit le diéther suivant :

La nécessité d'élucider quelques problèmes soulevés par l'étude de l'acide di-(phénylpyruvique) nous a conduit à un certain nombre de recherches dont voici les principaux résultats :
1° L'oxydation des trois oxolactones suivantes, l'a oxo b phényl g benzylbutyrolactone (X), l'a oxo bg diphénylbutyrolactone (XI), l'a oxo b phénylbutyrolactone (XII) s'effectue suivant le même schéma.
Elle fournit de l'acide oxalique et une cétone alcool à réductrice, du type des benzoïnes. Les produits obtenus sont le benzoylbenzylcarbinol (V), la benzoïne et le benzoylcarbinol :

Cette réaction semble présenter un caractère de généralité. Elle devrait permettre d'obtenir un certain nombre de benzoïnes mixtes, alors que les méthodes généralement employées fournissent les benzoïnes symétriques.
2° La saponification à chaud, et dans un milieu maintenu voisin de la neutralité, de l'éther mono-méthylique de l'acide di-(phénylpyruvique) (XIII) fournit les deux acides phényl-benzylsucciniques stéréoisomères (XIV) :

Ces acides peuvent être séparés, grâce à la grande différence de solubilité de leurs sels de calcium ; ils présentent des propriétés analogues à celles des acides phényléthylbenzylsucciniques décrits par M. le professeur Bougault, et des acides dibenzylsucciniques décrits par M. Cordier. L'un, au moins, de ces acides, n'avait pas été obtenu auparavant, à l'état de pureté.
3° L'acide phénylpyruvique et l'acide benzylpyruvique réagissent vis-à-vis du sulfate de méthyle sous une forme énolique et donnent les composés acides XV et XVI :

Le point essentiel qui se dégage de l'ensemble de ces résultats est l'analogie qui existe entre les réactions de l'acide di-(phénylpyruvique) et celles des oxolactones d'Erlenmeyer.
On peut exprimer cette analogie et le caractère propre de l'acide di-(phénylpyruvique) par la représentation suivante :
1° L'acide di-(phénylpyruvique) est un monoacide cétonique et lactonique qui se comporte parfois comme un diacide, d'autres fois comme un monoacide lactonique et énolique :

2° Les oxolactones sont des lactones énoliques à caractère acide qui peuvent, dans certains cas, réagir comme des lactones cétoniques, dans d'autres cas comme des acides cétoniques.

Nous rappelons les composés nouveaux qui ont été obtenus au cours de ce travail :
L'acide a oxy b phényl g benzyl butyrolactone g carbonique fondant à 225° :
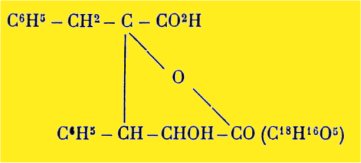
Son dérivé acétylé qui fond à 168°.
Un isomère de cet acide fondant à 136° et représenté par l'une des deux formules :

L'acide b phényl g benzyl ag dioxyglutarique fondant vers 140° :

Son éther diméthylique fondant à 131°.
L'éther méthylique de l'acide b phényl g benzyl a oxybutyrolactone g carbonique fondant à 132° :

L'acide benzoylbenzylglycollique qui se décompose au-dessous de 100° :

L'acide phénylbenzylsuccinique fondant à 185° (bloc Maquenne) :

Son éther méthylique fondant à 85°.
Son anhydride fondant à 73°.
L'acide a méthoxycinnamique fondant à 128° :
C6H5 - CH = C(OCH3) – CO2H (C10H10O3)
L'acide de formule :
C6H5 - CH2 - CH = C(OCH3) – CO2 (C10H10O3)
fondant à 36°-37°.
MOTS CLEFS : acide / action / benzoïne / benzoylbenzylcarbinol / benzoylbenzylglycol / benzyl / benzylbutyrolactone / benzylpyruvique / bougault / butyrolactone / carbonique / cétonique / diacide / dioxyglutarique / énolique / erlenmeyer / éther / formule / hydrogénation / lactone / lactonique / méthyle / oxolactone / oxydation / phényl / phénylpyruvique / propriété / résultat / saponification / sulfate