Thèse présentée à la faculté des sciences de l’Université de Paris
pour obtenir le grade de Docteur de l’Université
(mention : Sciences)
par
Pierre JACQUIGNON
CONTRIBUTION A L'ETUDE DE LE 6-AMINO-TETRALINE ET DE SES DERIVES
soutenue le 9 juin 1951
devant la commission d’examen :
Aubel, président
Prévost, Laffite, examinateurs
INTRODUCTION
La chimie de la 6-amino-tétraline (1,2,3,4, tétrahydro, 6 aminonaphtalène) (I) a déjà suscité de très nombreux travaux à la fois pour ses modes de préparation et pour ses propriétés chimiques.
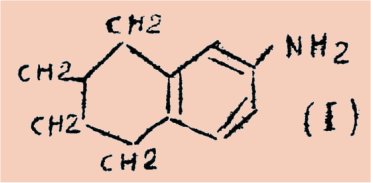
Il nous est apparu pour les raisons exposées plus bas qu’il pourrait être fructueux, tant du point de vue chimique que biologique d'étudier les possibilités de synthèse, à partir de cette amine utilisée comme matière première, de composés nouveaux d’intérêt biologique et en particulier de composés hétérocycliques azotés.
En effet, on sait que dans la chimie de substances polycycliques cancérigènes ou des substances antégonistes de cancérigènes les benzacridines jouent un rôle de premier plan.
En effet, depuis 1945 à l’Institut du Radium, Lacassagne, Buu-Hoï et Rudali ont étudié le pouvoir cancérigène de nombreuses benzacridines angulaires et plusieurs de ces corps se sont révélés actifs.
Les expériences faites par ces savants ont montré que les 7,8 benzacridines possédant en position méso un groupement méthyle, provoquant très souvent la formation d*épithéliomas par badigeonnage de la peau, et des sarcomes par injections sous-cutanées chez la souris.
La 3,10-diméthyl –7,8 benzacridine par exemple (II) est une des substances cancérigènes les plus actives existant à l’heure actuelle.

Au contraire les 5-6-banzacridines (noyau fondamental, IIl) sont en générales inactives ou parfois très faiblement actives d’aprés les mêmes auteurs.
Toutes ces benzacridines ont été synthétisées soit au départ de naphtylamines et de naphtols selon la réaction d’Ullmann-Fett-Vadjian soit de N-aryl naphtylamines selon la réaction de Bernthsen.
Ces réactions conduisent dans tous les cas à l’obtention de benzacridines angulaires car on sait que les cyclisations affectant des corps comportant un noyau naphtalène substitué en position b entraînent en général, la cyclisation sur le sommet a adjacent activé et non sur le sommet b adjacent.
En raison de cette accessibilité les benzacridines angulaires sont bien connues à l’heure actuelle et plusieurs centaines en ont déJà été synthétisées : par Ullmann, par Senior et Austin, par Landauer et surtout récemment par Buu-Hoï.
Les benzacridines linéaires par contre sont encore très peu connues. Seules quelques 2,3 benzacridine (IV) obtenues par Schöpff et 1,2 : 6,7-dibenzacridine synthétisée par Strohbach ont déjà été décrites dans la littérature, et encore ces corps n'ont jamais été soumis à l’étude biologique.

Nous avons pensé qu’un moyen commode pour accéder aux benzacridines linéaires serait d'utiliser la propension des dérivés 6-substitués de la tétraline à fournir des réactions de cyclisation affectant la position 7, le cycle saturé de la tétraline jouant le rôle de deux radicaux alkyles plutôt que celui d'un noyau benzénique.
De nombreux exemples de la réactivité de la position 7 nous sont donnés dans la littérature Schroeter par exemple réalisa la nitration en 7 de composés substitués en –6 (II).
Nous avons préparé en grandes quantités notre matière première (I) par une méthode utilisant la transposition de Beckman sur l'oxime du 6-acétyl-tétraline, méthode qui est plus commode que celles décrites dans la littérature et qui utilisent la nitration de la tétraline pour accéder ou dérivé aminé.
Nous avons préparé, très commodément notre matière première, la 6-amino-tétraline, en grosses quantités par une méthode différente de celles préconisées jusqu'à présent dans la littérature.
Cette méthode consiste à faire subir la transposition de Beckmann à l'oxime de la 6 acétyl-tétraline (VI, VII) et à saponifier par l’acide chlorhydrique la 6-acétamino-tétraline ainsi obtenue (VIII et I).

Cette méthode bien que chère, en raison du prix des sels d’hydroxylamine nous semble plus commode que celles déjà décrites telles que la nitration avec réduction du dérivé nitré par exemple, selon VESELY et CHUDOZILOV ou selon SCHROSTER.
L'action des. naphtols a et b sur le 6-amino-tétraline, selon la réaction d'ULMAM-FETTVADJIAN conduit respectivement (en présence de formaldéhyde) à la 6,7 têtraméthylène -1,2 benzacridine (IX), et à la 6,7 tétraméthylène -3,4 benzacridine (X).
Cette réaction peut également être mise en oeuvre avec des homologues supérieurs du b naphtol, tel que le 6 terbutyl-2 naphtol qui conduit à la 6,7 tétraméthylène –(3’ terbutyl 3,4 benzacridine (XI)

Le traitement par le sélénium des benzacridines (IX) et (X) nous a permis de déshydrogéner la benzacridine (X) en 3,4 : 6,7 dibenzacridine (XII) substance de propriétés identiques à celles décrites par STROHBACH ; de même la déshydrogénation de la benzacridine (IX) nous a conduit à la 1,2 : 6,7 dibenzacridine, corps non encore décrit jusqu'ici (V).
A notre connaissance de telles déshydrogénations par le sélénium des dérivés hydrogénés de l'acridine n'avaient pas encore été signalées jusqu'ici dans la littérature. Le succès de nos hydrogénations montre que le noyau acridine est beaucoup plus stable que le noyau carbazole car des traitements analogues de carbazoles hydrogénées ont jusqu'ici en général conduit à une rupture de la molécule.
Les dibenzacridines (V) et (XII) sont des isologues azotés du 1,2 benzo-tétracène (XIIl).

A la différence de ce dernier, elles semblent moins oxydables. Elles se différencient des dibenzacridines - bisangulaires telle que la 1,2 : 5,6 dibenzacridine (XIV), par leur couleur et de celle de leur picrate qui sont plus prononcées comme d'ailleurs on pouvait le prévoir d'après les relations entre structure électronique et couleur des molécules.

La réaction de Bernthsen pour la préparation des acridines substituées en position méso consiste à condenser des diarylamines secondaires Ar - NH - Ar avec un acide R – CO2H en présence d'un déshydratant le chlorure de zinc.
Cette méthode a été considérablement améliorée par BUU-HOl et LECOQ qui ont substitué les anhydrides d'acide aux acides eux-mêmes ce qui permet d'abaisser la température de réaction et la quantité de désbydratant, c’est cette technique que nous avons utilisée pour synthétiser des benzacridines méso-substituées à partir des 2 amines secondaires (XV et XVI) la 6-tétralyl - N-alphanaphtylamine et la 1,2-3-4 tétrahydro -b -b- dinaphtylamine préparées à partir de la. 6-aminotétraline des napntols a et b selon la méthode de Knoevenagel qui utilise l'iode comme catalyseur.

Dans la série des 1,2 benzacridines, nous avons obtenu les 10-méthyl - 6,7 tétraméthylène - 1,2 benzacridine (XVII) et 10-éthyl - 6,7 tétraméthylène - 1,2 benzacridine (XVIII) par condensation avec les anhydrides acétique et propionique.
De même dans la série des 3,4 benzacridines, nous avons abouti en partant de la 1,2,3,4 tétrahydro - dinaphtylamine à la 10-méthyl - 6,7 tétraméthylène - 3,4 benzacridine (XIX) et à la 10-éthyl - 6,7 tétraméthylène - 3,4 benzacridine (XX).

La recherche du pouvoir cancérigène de ces corps est actuellement faite par le docteur ZAJDELA au laboratoire de Monsieur le Professeur LACASSAGNE.
Les benzacridines ne sont pas les seuls composés hétérocyliques azotés présentant un intérêt pour la cancérologie.
On sait en effet que certains benzocarbazoles tel que le 9-méthyl 1,2 benzocarbazole (XXI) sont cancérigènes ou inhibiteurs de la croissante des tumeurs greffées.

Nous avons donc été amenés à préparer dans notre série trois composés de ce groupe :
Le 2,3 tétraméthylène - 5,6 dihydro - 7,8 benzocarbazole (XXII)
Le tétraméthylène - 5,6 dihydro – (1’,2’,3’,4’ tétrahydro) 7,8 naphtocarbazole et enfin le 2,3 tétraméthylène - 5,6: l',2' indénoindole (XXIV).

La méthode utilisée pour la préparation de ces corps est .celle de FIECHER-BORSCHE modifiée par BUU-HOI et qui consiste dans notre cas à cycliser la 6-tétralylhydrazone de la tétralone, de la tétralyltétralone et de l'indanone en chacun des trois benzocarbazoles sus-nommés au moyen d'une solution de gaz chlorhydrique dans l'acide acétique.
Un troisième groupe de composés hétérrocycliques azotés qui nous intéresse ici est celui des phénarsazines dont quelques représentants synthétisés par BUU-HOI et ROYER dérivés des 1,2 et 3,4 benzophénarsazines, noyau fondamental (XXV) et (XXVI} et étudiés biologiquement par le Docteur RUDALI, ont donné des tumeurs.

La condensation avec le trichlorure d’arsenic des diarylamines secondaires sus-nommées (XV et XVI) selon la méthode de WIELAND - RHEINHEIMER a produit avec la 6-tétralyl –N-a naphtylamine la 6,7 tétraméthylène -10-chloro - 9,10 dihydro –1,2 benzophénarsazine (XXVII) et avec la 1,2,3,4 tétrahydro bb dinaphtylamine : la 6,7 tétraméthylène - 10-chloro - 9,10 dihydro 3,4 benzophénarsazine (XXVIII).
Comme l'ont montré SEYBE et GORSKI, puis BUU-HOI et ROYER, il est possible de remplacer les atomes de chlore chez ces phénarsazines par groupements alkyles au moyen des organomagnésiens de GRIGNARD.
En faisant agir les iodures de méthyl et déthyl-magnésium la 6,7 tétraméthylène - 10-chloro - 9,10 dihydro - 1,2 benzophénarsazine, nous avons obtenu respectivement la :
6,7 tétraméthylène - 10-méthyl - 9,10 dihydro - 1,2 benzophénarsazine (XXIX) et la 6,7 tétraméthylène - 10-éthyl - 9,10 dihydro 1,2 benzophénarsazine (XXX). L'action des organomagnésiens sur la 6,7 tétraméthylène -10-chloro - 9,10 dihydro - 3,4 benzophénarsazine nous a de même conduit à la :
6,7 tétraméthylène - 10-méthyl - 9,10 dihydro - 5,4 benzophénarsazine (XXXI) et à la 6,7 tétraméthylène - 10-éthyl - 9,10. dihydro 3,4 benzophénarsazine (XXXII).

Comme nous l'avons signalé plus haut, les dérivés 6-substitués de la tétraline fournissent à leur tour des réactions de substitution en 7.
Dans le présent travail nous avons été amenés à préparer une amine de ce groupe : la 7-éthyl - 6-aminotétraline (XXXIII) et à comparer sa réactivité à celle de son sous-homologue.
La méthode de préparation de cette amine nouvelle est calquée sur celle de la 6-aminotétraline. Elle consiste à acétyler la 7-éthyltétraline et à faire la classique transposition de BECKMAM sur l'oxine de la 6-acétyl - 7-éthyl tétraline ainsi obtenue (XXXIV, XXXV, XXXVI, XXXVII).

Cette préparation bien qu'un peu ardue, est très commode et nous a conduit à une amine très pure qui tout comme son sous-homologue se prête très bien à la réaction d'ULLMAM-FETTVADJIAN.
A la différence de la 6-aminotétraline (l) elle a donné naissance à des dibenzacridines
bisangulaires.
Opposée au b naphtol elle a fourni la :
8-éthyl- 5,6 tétraméthylène - 3,4 benzacridine (XXXVIIl). De même par réaction avec
l’a naphtol, nous avons obtenu la :
8-éthyl- 5,6 tétraméthylène – 1,2 benzacridine (IXL), ainsi que la :
8-éthyl - 5,6 tétraméthylène – (3’terbutyl) - 3,4 benzacridine (XL) par condensation avec le 6 terbutyl - 2 naphtol.

La déshydrogénation par le sélénium de la benzacridine (XXXVIIl) nous a conduit à la :
8-éthyl - 3,4 : 5,6 dibenzacridine (XLI).
De même la déshydrogénation du composé (IXL), nous a fourni la :
8 éthyl - 1,2 : 5,6 dibenzacridine (XLIl).

Tous ces composés sont également soumis à des essais biologiques.
En complément aux recherches mentionnées ci-dessus et toujours dans un même but, nous avons également soumis la 6-aminotétraline et la 6-amino-7-éthyltétraline à d'autres synthèses.
Tout d'abord nos deux matières premières ont été soumises à la synthèse de Knorr-Pall (condensation avec l’acétonyl-acétone et formation de 2,5-diméthylpyrroles N-substitués).
C'est en appliquant cette réaction à la 6-aminotétraline nous avons accédé au : 1 (6'tétralyl) 2,5 diméthylpyrrole (XLIII).
De même, avec la 6-amino - 7-éthyltétraline, nous sommes arrivés au : 1 (7’éthyl 6’tétralyl) - 2,5 diméthylpyrrole (XLIV).
Une autre synthèse que nous avons faite avec nos deux amines fut celle de BEYER-COMBES : condensation d'amines primaires avec l’acétylacétone et formation de 2,4 diméthyl-quinoléines.
L’application de cette réaction à la 6-aminotétraline nous a fourni la 2,4 diméthyl - 6,7 tétraméthylène quinoléine (XLV) et à la 6-amino - 7-éthyltétraline, la 2,4 diméthyl - 8-éthyl - 5,6 tétraméthylène quinoléine (XLVl).

CONCLUSION
Au terme de ce travail nous pouvons tirer les conclusions suivantes :
1°- Nous avons préparé notre 6-aminotétraline selon une méthode commode, bien que coûteuse, évitant le passage par la nitration.
A partir de cette 6-aminotétraline, nous avons synthétisé toute une série de benzacridines linéaires, de phénarsazines et de carbazoles pouvant présenter un intérêt biologique et dont l'activité est actuellement à l'étude dans le laboratoire de M. le Professeur LACASSAGNE.
La 6-aminotétraline s'est donc révélée comme une matière prémière importante, pour la synthèse de tels hétérocycles comportant un cycle saturé, grâce à la propension de son sommet-7 à donner des réactions de cyclisation.
2°- Les déshydrogénations que nous avons faites sur certaines des benzacridines obtenues, nous ont permis d’accéder facilement à des dibenzacridines linéaires, dont les rares exemples signalés dans la littérature avaient été obtenus d'une façon très compliquée.
D'autre part, ces déshydrogénations par le sélénium à 360° ont montré que le noyau acridine est stable lors de telles réactions contrairement à certains carbazoles aux ROSNERR avait subir le même traitement.
3°- L’application de diverses réactions à la 7-éthyl –6-aminotétraline homologue supérieur de la 6-aminotétraline, a montré que la première nommée à une réactivité sensiblement égale à celle de la 6-aminotétraline.
En effet, elle a fourni de très jolies benzacridines bisangulaires (à cause de l’encombrement en position bêta) et un certain nombre d’autres dérivés avec la même facilité que son sous-homologue
Les déhydrogénations de benzacridines comportant un groupement éthyl en 8 ont eu lieu avec un succès identiques aux précédentes.
4°- A partir de 2 amines sus-nommées, nous avons préparé un certain nombre de dérivés également susceptibles d'applications biologiques : quinoléines, pyroles, sulfamides.
En outre au cours de ce travail nous avons isolé 36 corps qui à notre connaissance ne sont pas encore signalés dans la littérature. Ce sont les composés :
(V) et son picrate, (IX) et son picrate. (X) et son picrate, (XI) et son picrate. (XV), (XVI), (XVII) et son picrate, (XVIII), (XIX), (XX) et leurs picrates, (XXII), (XXIII) et leurs picrates, (XXIV), (XXVII). (XXVIII), (XXIX), (XXX), (XXXI), (XXXII), (XXIII). (XXXV), sa semi et sa thiosemicarbazone, (XXXVI), (XXXVII), (XXXVIII), (XXXIX). (XL) et leurs picrates, (XLl) et (XLII) et leurs picrates, (XLIII). (XLIV). (XLV), (XLVI) et leurs picrates, (XLVII), (XLVIII), (IL), (L), (LIV).
MOTS CLEFS : acridine / amine / amino / aminotétraline / benzacridine / benzocarbazole / benzophénarsazine / cancérigène / carbazole / condensation / cyclisation / dérivé / déshydrogénation / dibenzacridine / éthyl / éthyltétraline / homologue / méthode / méthyle / naphtol / picrate / préparation / quinoléine / réaction / synthèse / tétraline / tétraméthylène