Thèse présentée à la Faculté des Sciences de l'Université de Lyon
Pour obtenir le grade de Docteur es sciences physiques
Contribution à la chimie de flavonols
de
Annie
Grouiller
soutenue le 15 juillet 1965
devant la commission d'examen :
Colonge J., Président
Chopin J., Pachéco H., Mentzer C., Examinateurs
GENERALITES SUR LES COMPOSES FLAVONIQUES
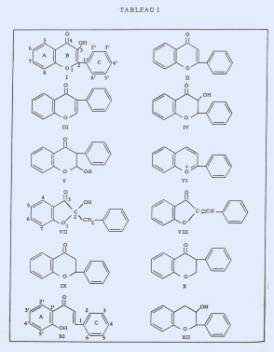
Les composés flavoniques,
substances très répandues dans le règne végétal, ont un squelette carboné de base en C15
présentant l'enchaînement C6 – C3 – C6. Le chaînon en C3 qui relie les deux
noyaux benzéniques peut avoir un degré d'oxydation plus ou moins élevé,
en fonction duquel peut s'établir la classification suivante par ordre
décroissant (tableau I) :
a) flavonol (l)
b) flavone (II), isoflavone (III),
hydroxy-3 flavanone ou flavanonol (IV), hydroxy-2 isoflavanone (V).
A ce groupe peuvent être
rattachées les anthocyanes (ou cation flavylium VI), les hydroxy-2 benzyl-2
coumaranones-3 (VIl) et les aurones (VIII), substances d'étude plus récente.
c) flavanone (IX), isoflavanone
(X), chalcone (XI)
d) hydroxy-3 flavane ou
"catéchine" (XII).
Tous ces composés flavoniques
ont des relations entre eux : par exemple, une chalcone est isomère d'une flavanone par
ouverture de l'hétérocycle, ce qui explique la facile interconversion d'une
forme dans l'autre ; une flavanone peut être convertie en flavanonol par
hydroxylation en position 3, un flavanonol en flavonol par déshydrogénation,
ou en flavone par déshydratation, etc...
Par contre, les propriétés d'un
composé flavonique déterminé sont souvent fonction de la nature et de la
position de ses substituants parmi lesquels les plus fréquemment rencontrés
sont certainement les radicaux hydroxyle, méthoxyle et glucosyloxyle. Parfois ces
substituants sont caractéristiques d'une famille de plantes.
LES GLUCOSIDES DE FLAVONOLS.
Une classe de composés
flavoniques naturels particulièrement intéressante est celle des glucosides de
flavonols. Chaque année, grâce à l'essor de nouvelles méthodes de séparation,
le nombre de ces glucosides isolés de végétaux s'accroît.
Les plus répandus sont
certainement les glucosyl-3 et glucosyloxy-7 flavonols, généralement
polyhydroxylés avec notamment un groupement oxhydryle en 5, ce qui confère au
noyau A le type phloroglucique.
CONCLUSIONS
1°) La première partie de notre
travail a été consacrée à l'élaboration d'une méthode générale de synthèse de b- D - glucosyloxy-7 hydroxy-5 flavonols, par hydroxylation des
glucosyloxy-7 hydroxy-5 flavanones correspondantes en glucosyloxy-7 flavanonols
par action de l'eau oxygénée à 0° en milieu alcalin (principe de la technique
de ALGAR-FLYNN-OYAMADA), puis déshydrogénation des glucosyloxy-7 flavanonols
obtenus en glucosyloxy-7 flavonols par action du bisulfite de sodium.
a) Les glucosyloxy-7 hydroxy-5
flavanones, bases de départ du procédé, peuvent être naturelles ou
synthétiques. Dans ce dernier cas, elles sont préparées par cyclisation des
diglucosyloxy-2', 4' hydroxy-6' chalcones correspondantes en diglucosyloxy-5, 7
flavanones, puis hydrolyse partielle de ces composés (chapitre I).
C'est ainsi qu'a été réalisée
la première synthèse :
- de la prunine
- de l'isosakuranine
- et de la glucosyl-7
hespérétine.
Les deux premières
glucosyloxy-7 flavanones ont présenté respectivement les mêmes critères
analytiques que la prunine et l'isosakuranine naturelles, y compris le pouvoir
rotatoire spécifique dont la valeur négative montre que ces composés ont été
obtenus synthétiquement sous la forme glucosyloxy-7 ( - ) flavanone.
La troisième glucosyloxy-7
flavanone n'a pas encore été isolée de végétaux.
b) Les diglucosyloxy-2', 4'
hydroxy-6' chalcones sont elles-mêmes synthétisées par condensation en milieu
alcalin d'un aldéhyde aromatique différemment substitué avec la
di-(tétraacétyl-2, 3, 4, 6 glucosyl)-2, 4 phloracétophénone.
Cette méthode a été mise au
point en 1942 par ZEMPLEN ; mais il croyait avoir obtenu des
dihydroxy-2', 6' monoglucosyloxy°4' chalcones, pensant avoir synthétisé
préalablement la mono°(tétraacétyl°2, 3, 4, 6 glucosyl)-4 phloracétophénone.
c) Les glucosyloxy-7 flavonols
qui ont été synthétisés sont les suivants :
- le glucosyl°7 kaempférol ou
populnine à partir de la prunine synthétique,
- le glucosyl°7 kaempféride ou
muménine à partir de l'isosakuranine synthétique,
-° la glucosyl-7 méthyl°4'
quercétine à partir de la glucosyl-7 hespérétine synthétique,
- le rhamnoglucosyl°7 kaempférol
à partir de la naringine naturelle,
- la rhamnoglucosyl°7 méthyl-4'
quercétine à partir de l'hespérédine naturelle.
Les deux premiers glucosyloxy-7
flavonols ont déjà été isolés de plantes ; par contre les trois autres sont des
composés nouveaux.
d) Les différents facteurs qui
influencent les deux réactions mises en jeu au cours de ces synthèses de
glucosyloxy-7 flavonols ont été étudiés. Cependant deux questions se posent
encore :
- dans quelles conditions la
méthode de conversion des monoglucosyloxy-7 flavanones en glucosyloxy-7 flavonols
peut-elle être appliquée aux diglucosyloxy-5, 7 flavanones, dans le but
d'obtenir les diglucosyloxy-5, 7 flavonols correspondants, composés très
rarement synthétisés jusqu'à présent ?
- quelle est la raison qui
provoque l'identité des pouvoirs rotatoires spécifiques des
glucosyloxy-7 flavanones optiquement actives naturelles et synthétiques. Est-ce dû
à une synthèse asymétrique de ces composés ; ou bien la forme lévogyre est-elle
séparée préférentiellement au cours de la synthèse, par exemple lors de la
recristallisation des diglucosyloxy-5, 7 ou des monoglucosyloxy-7 flavanones ?
2°) La seconde partie de notre
travail a vu la réalisation de la synthèse de b- D -
glucopyrannosyloxy-7 méthyl-3 flavonols et de b- D -
diglucopyrannosyloxy-3, 7 flavones polyhydroxylés, selon une méthode qui peut
se décomposer en trois étapes :
- condensation, en présence
d'oxyde d'argent, d'un a halogéno-acétyl-ose, l'a acétobromoglucose, avec un flavonol hydroxylé dont les
oxhydryles en 5 et 7 ou en 3, 5 et 7 sont libres, tandis que les oxhydryles du
noyau phényle C sont bloqués par le radical benzyle,
- débenzylation du glucoside
acétylé de flavonol benzyle obtenu, par hydrogénolyse en présence de noir de
palladium à 5%,.
- enfin, désacétylation par
traitement à 0 ° du glucoside acétylé de flavonol par une solution de soude à
2% dans le méthanol.
a) La première phase de ce
procédé, l'action de l'a acétobromo-glucose sur l'aglycone
hydroxylée, a été appliquée pour la première fois à la synthèse de glucosyloxy-
flavonols par JERZMANOWSKA ; l'importante amélioration que nous lui avons
apportée est le blocage des oxhydryles du noyau C par le radical protecteur
benzyle, déjà préconisé par TEOULE pour la synthèse de glucosyloxy- flavones,
et dont l'avantage est d'être éliminé ensuite facilement, sans dommage pour le
radical glucosyle.
b) Les benzyloxy- flavonols,
points de départ de la méthode, ont été synthétisés par application de la
technique d'ALLAN - ROBINSON, c'est-à-dire, la condensation d'une w-hydroxy-acétophénone dont l'oxhydryle en w est protégé par un groupement méthyle ou benzoyle, avec un
anhydride d'acide aromatique dont les oxhydryles sont benzylés, en présence du
sel de potassium de cet acide.
Pour faciliter cette
condensation, nous l'avons effectuée sous vide et en présence de sable.
c) Les glucosyloxy- flavonols
qui ont été synthétisés sont les suivants :
- le glucosyl-7 méthyl-3
kaempférol à partir du méthyl-3 benzyl-4' kaempférol,
- la glucosyl-7 méthyl-3
quercétine à partir de la méthyl-
3 dibenzyl-3', 4' quercétine,
- la diglucosyl-3, 7
isorhamnétine à partir de la méthyl- 3' benzyl-4' quercétine.
Ces trois composés sont
nouveaux.
Bien que les synthèses de
glucosyloxy- flavonols que nous avons réalisées soient en nombre restreint,
elles montrent .cependant que la méthode mise au point est très générale,
puisqu'elle conduit aussi bien à l'obtention de monoglucosyloxy-7 que de
diglucosyloxy-3, 7 flavones polyhydroxylées, donc à la grande majorité des
glucosides de flavonols naturels déjà connus.
d) En outre, les benzyloxy-
méthyl-3 flavonols synthétisés nous ont permis d'obtenir, par simple
débenzylation, des méthyl-3 flavonols ; et par benzylation de l'oxhydryle en 7,
méthylation de l'oxhydryle en 5, et débenzylation totale : des diméthoxy-3, 5
flavones polyhydroxylées, composés nouveaux encore jamais synthétisés.
Ont été ainsi préparés :
- le méthyl-3 kaempférol
- la méthyl-3 quercétine
- la méthyl-3' quercétine ou
isorhamnétine
- la méthyl-3 myricétine,
composé nouveau.
|
- le diméthyl-3, 5 kaempférol |
} |
Trois composés nouveaux |
|
- la diméthyl-3, 5 quercétine |
||
|
- la diméthyl-3, 5 myricétine |
La diversité de ces produits
fut suffisamment grande pour les soumettre à une étude spectrale comparative
dans l'ultraviolet et l'infrarouge dont le résultat fut l'élaboration de lois
relatives à l'influence de la méthylation en 3, ou en 5, ou en 3 et 5 sur
l'allure des spectres ultraviolet et infrarouge d'un flavonol polyhydroxylé.
L'intérêt essentiel de notre
travail a donc résidé dans l'élaboration de méthodes de synthèse de
glucosyloxy- flavonols polyhydroxylés et de méthoxy-5 méthyl-3 flavonols,
composés rarement synthétisés jusqu'à présent, mais dont l'obtention est
nécessaire à la caractérisation de substances naturelles, ces différents composés
jouant le rôle de corps de référence.
MOTS CLEFS :
action / aglycone / anthocyane / aromatique /
benzénique / benzoyle / benzyle / chalcone / condensation / débenzylation / déshydrogénation /
flavanone / flavanonol / flavone / flavonique / flavonol / glucoside / glucosyl / grouiller /
hespérétine / hydroxylation / kaempférol / méthode / méthyle / naturel / oxhydryle /
phloracétophénone / phloroglucique / plante / prunine / quercétine / synthèse / synthétique /
végétal