Thèse présentée à la faculté des sciences de Lyon
pour obtenir le titre d’Ingénieur-Docteur
par
Cécile GERPHAGNON
Nouvelles synthèses de coumarines non substituées en position 4
soutenue le 21 octobre 1961
devant la commission d’examen :
J. Colonge, président
J. Chopin, R. Paris, C. Mentzer, examinateurs
INTRODUCTION
Les coumarines, ou benzo a-pyrones, constitue un groupe important de composés naturels, isolés du domaine végétal, à l'état libre ou combiné.
La synthèse des coumarines naturelles par les méthodes classiques est rendue souvent délicate par la difficulté d'obtention des matières premières. Or les études structurales entreprises jusqu'à ce jour permettent de les classer de la manière suivante
1- Groupe de la coumarine simple
exemple : coumarine
2- Groupe des hydroxy ou alkoxy coumarines
exemple : citroptène
3— Groupe des hydroxy ou alkoxy coumarines possédant un reste alkyl ou alkényl
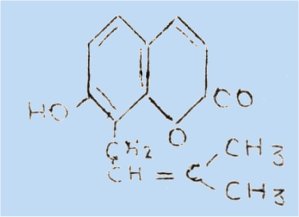
exemple ; osthénol
4- Groupe des furocoumarines possédant un noyau furane greffé sur le noyau benzénique
exemple : psoralène
5- Groupe des pyronochromènes
exemple : xanthylétine
Un examen attentif de ces différentes structures montre que si des substituants divers peuvent occuper n'importe quelle position sur le noyau benzénique ou pyrannique, la position 4 n'est que très rarement occupée. Hormis quelques phényl-4 coumarines récemment découvertes, il n'y a en effet, à notre connaissance que trois hydroxy-4 coumarines naturelles : le dicoumarol, l'ammorésinol (I) et l'isoshekanigénine (II), et deux benzo-5,4 coumarines : l'alternariol et son éther méthylique (III).
Le problème de la synthèse des coumarines naturelles est donc lié à celui de la synthèse des coumarines non substituées on position 4. C'est l'objet de notre travail que nous avons exposé de la manière suivante :
Après avoir rappelé dans un préliminaire les méthodes classiques d'obtention de ces coumarines, nous avons envisagé différentes méthodes nouvelles qui font chacune l'objet d'un chapitre.
CHAPITRE 1 - Condensation thermique des phénols avec, l'éthoxyméthylène malonate d'éthyle.
Nous savions que les esters b-cétoniques et maloniques mono substitués peuvent se condenser avec les phénols à chaud et en l'absence de catalyseurs pour conduire à des chromones, des flavones et des hydroxy-4 coumarines.
L'emploi de l’éthoxyméthylène malonate d'éthyle jouant le rôle d'ester b-cétonique, nous a conduit dans tous les cas à des dérivés coumariniques non substitués en position 4.
Nous avons également comparé cette application nouvelle de la condensation thermique à des méthodes catalytiques utilisant, soit l'éthylate de sodium, soit l'acide sulfurique concentré, inemployé encore dans ce domaine.
Cette méthode thermique nous a permis de synthétiser des hydroxy et alkoxy coumarines naturelles.
CHAPITRE II - Déshydrogénation des dihydrocoumarines
Nous pouvions aussi envisager l'obtention de coumarines non substituées en position 4, par déshydrogénation des dihydrocoumarines correspondantes.
Tout d'abord, pour préparer ces dihydrocoumarines par une méthode de synthèse directe, nous nous sommes proposé d'appliquer le procédé de condensation thermique.
Nous connaissions la grande facilité avec laquelle les bases de Mannich phénoliques se condensent par voie purement thermique avec les hydroxy-4 coumarines. Envisageant alors une toile condensation de ces bases avec les malonates d'éthyle, nous pensions accéder aux dihydrocoumarines.
Contrairement à nos prévisions, nous avons obtenu, non pas des dihydrocoumarines, mais une spirodihydrocoumarine, dont nous avons fait une étude approfondie et démontré la structure par voie synthétique.
Cette méthode n'aboutissant pas aux dihydrocoumarines attendues, n'a pas été poursuivie plus avant.
CHAPITRE III - Hydroxylation et déshydroxylation des coumarines.
Dans certains cas, on peut envisager que la biogenèse des composés en C6C3 ou C3C6C3, plus ou moins hydroxylés, se fait par oxydation nucléaire ou par réduction. Nous avons voulu vérifier au laboratoire, un tel passage dans le domaine des coumarines, et l'appliquer par la suite à la synthèse de coumarines non substituées en 4.
L'étude de l'oxydation nucléaire, par la méthode d'EIbs, nous a effectivement montré ce passage. Ainsi nous avons pu obtenir des polyhydroxycoumarines à partir des monohydroxycoumarines correspondantes.
Mais surtout l'étude de la réduction nucléaire nous a permis de passer, au moyen d'une méthode originale et spécifique, des hydroxy-4 coumarines, faciles d'accès, aux coumarines non substituées en position 4, par l'intermédiaire de leur ester tosylique.
Nous avons pu étendre cette méthode qui s'est montrée très générale, à la synthèse de nombreuses coumarines.
Nous avons ainsi obtenu quelques furocoumarines naturelles, particulièrement difficiles à préparer. Nous avons également pu mettre en évidence, un passage des furochromones aux furocoumarines. Du point de vue biogénétique, ce résultat nous permet dès lors de leur envisager un précurseur commun, étant donné leur présence dans des espèces végétales apparentées.
Nous nous étions proposé la mise au point de nouvelles méthodes de synthèses de coumarines non substituées en position 4 nous donnant ainsi accès aux coumarines naturelles. La première méthode envisagée, la condensation thermique des phénols avec l’éthoxyméthylène malonate d'éthyle nous a permis d'obtenir de telles coumarines.
Nous avons pu ainsi synthétiser :
- l’ombelliférone, le citroptène, l’esculétine et leurs dérivés dans le domaine des coumarines naturelles, à partir respectivement de la résorcine, de la phloroglucine et de l’oxyhydroquinone.
- la benzo-5,6 et la benzo-7,8 coumarines. dans le domaine des coumarines purement synthétiques, à partir du b-naphtol et de l’a-naphtol, montrant la réactivité particulière des naphtols voisine de celle des polyphénols : dans ce type de condensation, en effet, les monophénols ne nous ont donné aucun résultat.
II est intéressant de noter, que dans le cas de la résorcine, des auteurs utilisant l’éthylate de sodium comme catalyseur, avaient également réussi cette condensation, aboutissant au même composé que la condensation thermique sans catalyseurs. Généralisant l’emploi de l’éthylate de sodium, nous avons constaté que seule la résorcine donne des rendements acceptables en coumarine.
Par contre, l’emploi de l’acide sulfurique qui n’avait jamais été étudié comme catalyseur dans ces condensations, donne dans la plupart des exemples, et avec des rendements souvent compétitifs avec la méthode thermique, des résultats analogues à cette dernière.
Dans une seconde méthode. nous pensions obtenir des coumarines non substituées on position 4 par deshydrogénation des dihydrocoumarines correspondantes.
Pour cela nous voulions réaliser une synthèse directe de ces dihydrocoumarines par condensation des bases de Mannich des phénols avec les malonates. Seule une spirodihydrocoumarine, la spiro-3,3’ bis (benzo-5,6 dihydro-3,4 coumarine) a pu être obtenue. Nous avons démontré sa structure par voie synthétique, par l’intermédiaire de l’acide [(méthoxy-2 napht)-yl-I] bis acétique. Mais nous avons du abandonné cette méthode comme nouvelle voie d’accès des coumarines non substituées en position 4.
Enfin, après l’oxydation nucléaire des coumarines, par application de la méthode d’ELBS de parahydroxylation par le persulfate de potassium, qui nous a permis de passer sans substitution préalable des coumarines monohydroxylées aux coumarines polyhydroxylées correspondantes. Nous avons pu mettre au point une méthode de déshydroxylation des coumarines qui nous a conduit des hydroxy-4 coumarines aux coumarines non substituées en position 4 correspondantes.
Dans cette dernière méthode, nous avons utilisé l’ester tosylique de ces hydroxy-4 coumarines, qui se laisse désulfoner dans un milieu réducteur approprié (Zn, HCl, alcool) valable seulement pour ces dérivés énoliques : l’emploi des coumarines possédant des hydroxyles nucléaires nous conduit à un échec.
Nous avons appliqué cette méthode originale à de nombreuses coumarines possédant des substitutions diverses, telles que méthyl ou phényl en 3, et des groupements méthyles, méthoxy ou benzo dans les autres positions.
Dans le domaines des coumarines naturelles, nous avons pu synthétiser ainsi des furocoumarines particulièrement difficiles d’accès et mettre en évidence un précurseur commun, étant donné leur présence dans des espèces végétales apparentées. C'est ainsi que la khelline, l’isokhelline et la visnagine nous ont permis, par la méthode de BOYD-ROBERTSON, d’obtenir les hydroxy-4 coumarines correspondantes, puis par notre méthode de réduction, de passer respectivement à l’isopimpinelline à la pimpinelline et la bergaptène. MOTS CLEFS :
catalyseur / composé / condensation / coumarine / dérivé / dihydrocoumarine / domaine / elbs / emploi / ester / éthoxyméthylène / éthylate / éthyle / étude / furocoumarine / hydroxy / malonate / mannich / méthode / naphtol / naturel / phénol / position / réduction / résorcine / structure / synthèse / thermique / végétal 




|
|
visiteurs |
|---|